Содержание
- 2. Определение Газ (газообразное состояние) (от нидерл. gas) — агрегатное состояние вещества характеризующееся очень слабыми связями между
- 3. Газообразное состояние вещества в условиях, когда возможно существование устойчивой жидкой или твёрдой фазы этого же вещества,
- 4. Подобно жидкостям, газы обладают текучестью и сопротивляются деформации. В отличие от жидкостей, газы не имеют фиксированного
- 5. Газообразное состояние — самое распространённое состояние вещества Вселенной (межзвёздное вещество, туманности, звёзды, атмосферы планет и т.
- 6. Некоторые частные случаи Идеальный газ — газ, в котором взаимодействие между молекулами сводится к парным столкновениям,
- 7. Этимология Слово «газ» (нидерл. gas) было придумано в начале XVII века фламандским естествоиспытателем Я. Б. ван
- 8. Физические свойства газов Большинство газов сложно или невозможно наблюдать непосредственно нашими органами чувств, они описываются с
- 9. Физические свойства газов Основной особенностью газа является то, что он заполняет всё доступное пространство, не образуя
- 10. Физические свойства газов В поле сил тяготения плотность и давление не одинаковы в каждой точке, уменьшаясь
- 11. Физические свойства газов Газ имеет высокую сжимаемость — при увеличении давления возрастает его плотность. При повышении
- 12. Микроскопические характеристики Если бы можно было наблюдать газ под мощным микроскопом, можно было бы увидеть набор
- 13. Тепловое движение молекул газа Важнейшей чертой теплового движения молекул газа — это беспорядочность (хаотичность) движения. Экспериментальным
- 14. Броуновское движение Одним из самых интересных явлений, подтверждающих хаотичность движения молекул, является броуновское движение, которое проявляется
- 15. Электрический ток в газах Газ в ионизированном состоянии способен проводить электрический ток. Основных способа ионизации газа
- 16. Термическая ионизация Термическая ионизация — придание атомам достаточной кинетической энергии для отрыва электрона от ядра и
- 18. Скачать презентацию















 Сила. Силы в природе и Работа. Мощность
Сила. Силы в природе и Работа. Мощность Агрегатные состояния вещества. Строение твердых, жидких и газообразных тел Урок в 7 классе Учитель физики МОУ «СОШ
Агрегатные состояния вещества. Строение твердых, жидких и газообразных тел Урок в 7 классе Учитель физики МОУ «СОШ  Тюнинг автомобиля
Тюнинг автомобиля Механические волны
Механические волны Нанотехнологии
Нанотехнологии Электроосветительные приборы
Электроосветительные приборы Электроосветительные приборы
Электроосветительные приборы Определение перемещений. Лекция 6
Определение перемещений. Лекция 6 Устройство, с помощью которого человек выполняет физическую работу, или подвижная часть более сложного устройства
Устройство, с помощью которого человек выполняет физическую работу, или подвижная часть более сложного устройства Жизненный путь глуховатого изобретателя
Жизненный путь глуховатого изобретателя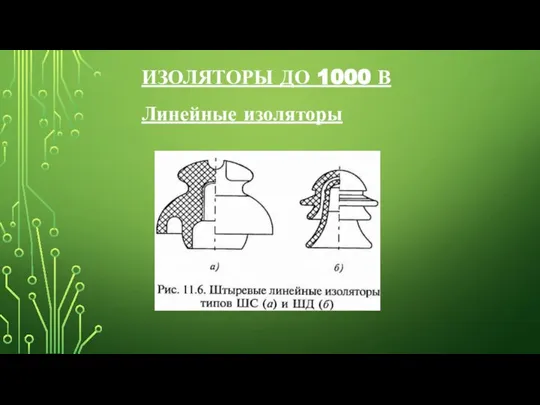 Изоляторы
Изоляторы Презентация на тему Ядерная модель атома.Квантовые постулаты Бора
Презентация на тему Ядерная модель атома.Квантовые постулаты Бора  Электричество и магнетизм. Лекция 09
Электричество и магнетизм. Лекция 09 Tesla
Tesla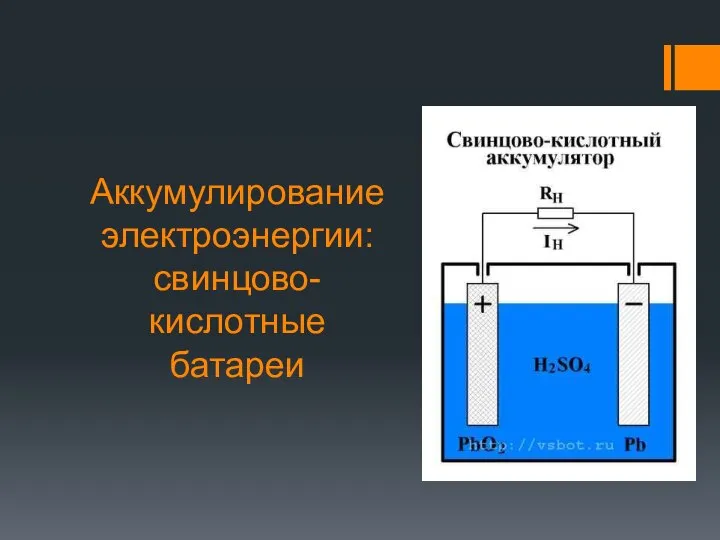 Аккумулирование электроэнергии. Свинцово-кислотные батареи
Аккумулирование электроэнергии. Свинцово-кислотные батареи Пузырьковая камера
Пузырьковая камера Что значит минута
Что значит минута Энергия. Работа. Законы сохранения. Лекция 5
Энергия. Работа. Законы сохранения. Лекция 5 Расчет давления на дно сосуда
Расчет давления на дно сосуда Механическое движение (7 класс)
Механическое движение (7 класс) Механическая работа. Мощность
Механическая работа. Мощность Измерение массы тела
Измерение массы тела Индукция поля прямого и кругового тока
Индукция поля прямого и кругового тока Источники света. Прямолинейное распространение света,
Источники света. Прямолинейное распространение света, Теплопроводность. Вязкость. Диффузия
Теплопроводность. Вязкость. Диффузия Законы сохранения в механике
Законы сохранения в механике Работа газа и пара при расширении. Двигатель внутреннего сгорания. КПД
Работа газа и пара при расширении. Двигатель внутреннего сгорания. КПД Динамика точки. Лекция 4
Динамика точки. Лекция 4