Содержание
- 2. Газ и давление газа Кинетическая теория и модель газа Идеальный газ Средняя скорость молекул газа Среднеквадратичная
- 3. Кинетическая теория связывает макроскопические измеряемые величины, такие как давление, объем и температура, с движениями в молекулярном
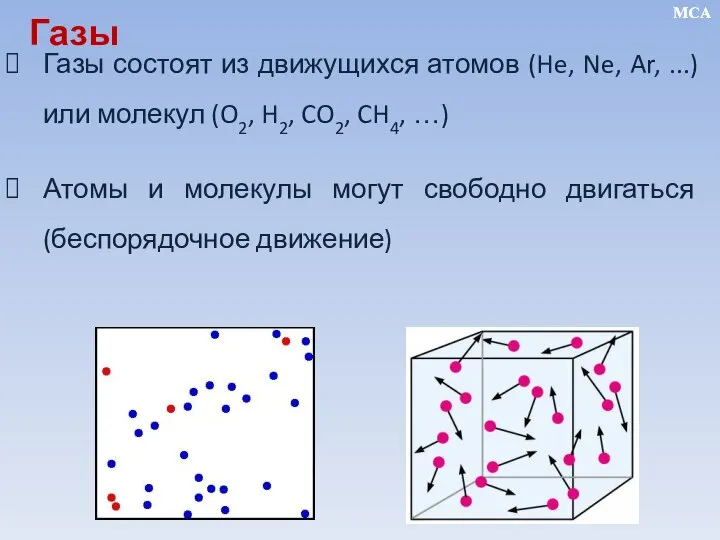
- 4. Газы состоят из движущихся атомов (He, Ne, Ar, ...) или молекул (O2, H2, CO2, CH4, …)
- 5. Как объяснить давление газа? Помните ... Давление - это сила F на единицу площади S (в
- 6. Есть много частиц (атомов или молекул), которые постоянно движутся в случайных направлениях Частицы очень маленькие и
- 7. В природе нет идеальных газов ... идеальный газ - это приближение! Так…. почему мы их изучаем
- 8. 1. В физике многие законы или понятия являются приближенными. Объясните, что подразумевается под приближением. 2. Сформулируйте
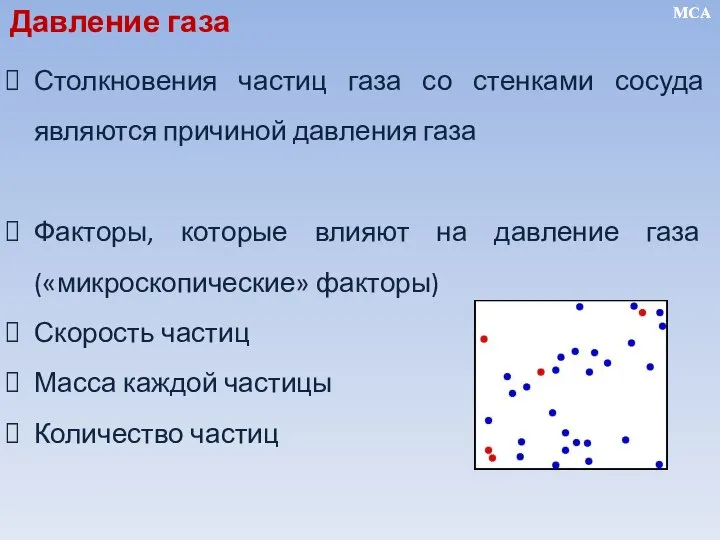
- 9. Столкновения частиц газа со стенками сосуда являются причиной давления газа Факторы, которые влияют на давление газа
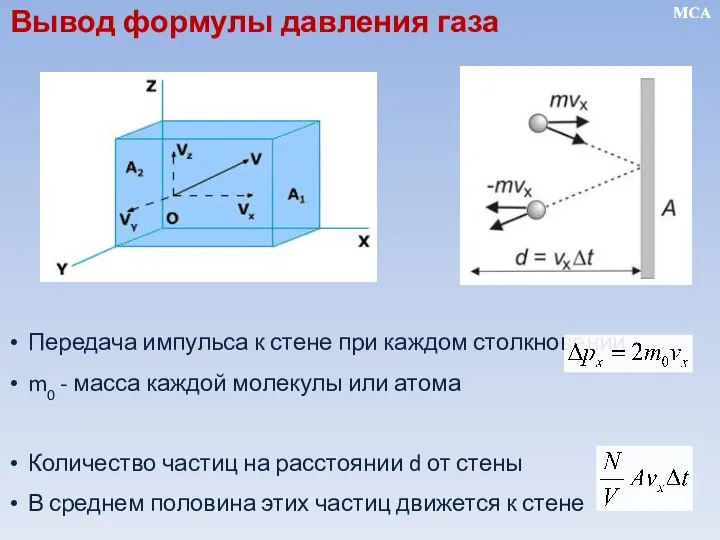
- 10. Передача импульса к стене при каждом столкновении m0 - масса каждой молекулы или атома Количество частиц
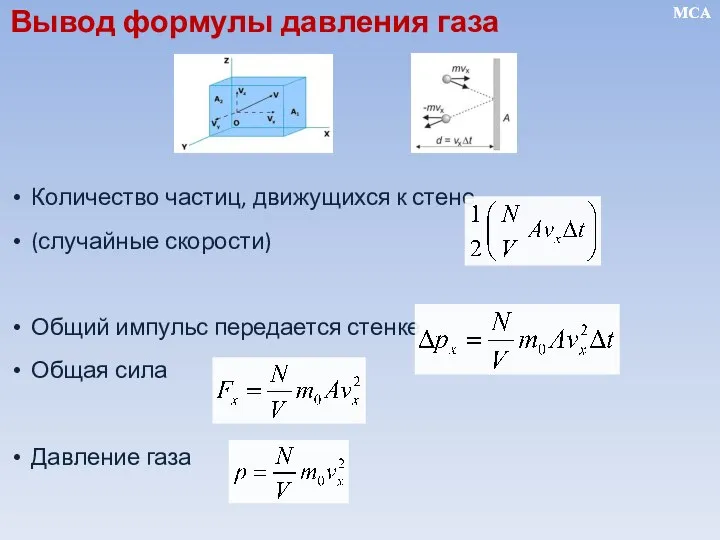
- 11. Количество частиц, движущихся к стене (случайные скорости) Общий импульс передается стенке Общая сила Давление газа MCA
- 12. Среднее значение квадрата скоростей Обозначение означает среднее значение v2 Среднее арифметическое Вычисляя скорости и беря квадратный
- 13. Случайное движение Среднее значение составляющих скорости одинаково в каждом направлении Среднее значение квадрата скорости MCA Вывод
- 14. Наконец ... мы находим уравнение, которое искали !!! MCA Вывод формулы для давления газа p давление
- 15. Среднеквадратичная скорость Среднеквадратичная скорость - это мера скорости частиц в газе. Он определяется как корень квадратный
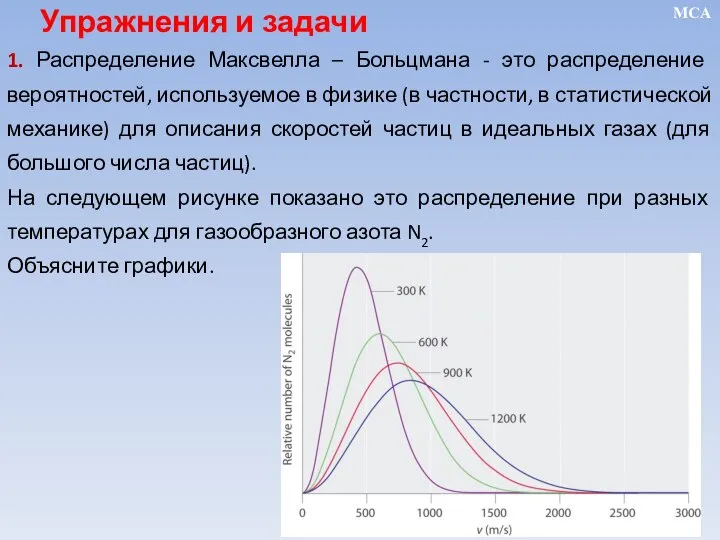
- 16. 1. Распределение Максвелла – Больцмана - это распределение вероятностей, используемое в физике (в частности, в статистической
- 17. 2. Скорости семи молекул в газе численно равны 2, 4, 6, 8, 10, 12 и 14υ,
- 18. 3. Гелий, который можно рассматривать как идеальный газ, запечатывается в металлический контейнер. Абсолютная температура затем удваивается.
- 19. 4. Оцените среднеквадратичную скорость молекулы азота в вашем классе. 5. а) Определите соотношение среднеквадратичных скоростей кислорода
- 21. Скачать презентацию













 Лекция 6 нелинейные электрические цепи постоянного тока
Лекция 6 нелинейные электрические цепи постоянного тока Модель атома Томсона. Модель атома Резерфорда. Атомные спектры. Лекция 12
Модель атома Томсона. Модель атома Резерфорда. Атомные спектры. Лекция 12 Презентация на тему Сила тока
Презентация на тему Сила тока  Исследование схемы измерения сопротивления заземлителя МС-08
Исследование схемы измерения сопротивления заземлителя МС-08 Электризация тел при соприкосновении. Два рода зарядов
Электризация тел при соприкосновении. Два рода зарядов Физика
Физика Урок-сказка: Первоначальные сведения о строении вещества 7 класс
Урок-сказка: Первоначальные сведения о строении вещества 7 класс oiyn-biznesi-saly-y_dlya-konkursa
oiyn-biznesi-saly-y_dlya-konkursa Курс лекций по молекулярной физике и термодинамике
Курс лекций по молекулярной физике и термодинамике Изопроцессы в газах, решение графических задач
Изопроцессы в газах, решение графических задач Что такое электричество?
Что такое электричество? История числа «π» 6 класс - Презентация_
История числа «π» 6 класс - Презентация_ Специальность автомехеник
Специальность автомехеник Влажность. Решение задач. 8 класс
Влажность. Решение задач. 8 класс Понятие о машине и механизме
Понятие о машине и механизме Электростатика. Закон Кулона
Электростатика. Закон Кулона Установочные лекции для студентов заочного отделения
Установочные лекции для студентов заочного отделения Физика и техника
Физика и техника Презентация по физике "Белый свет имеет сложную структуру" -
Презентация по физике "Белый свет имеет сложную структуру" -  Амплитудная цилиндрическая дифракционная линза. Расчет, изготовление с помощью фотолитографии и жидкостного травления
Амплитудная цилиндрическая дифракционная линза. Расчет, изготовление с помощью фотолитографии и жидкостного травления Графеннің коммерциализациясы
Графеннің коммерциализациясы Построение изображений в линзах. Виды линз
Построение изображений в линзах. Виды линз Сила. Силы в природе и Работа. Мощность
Сила. Силы в природе и Работа. Мощность Подбор стартера на автомобиль ВАЗ-2170
Подбор стартера на автомобиль ВАЗ-2170 Презентация на тему Постоянные магниты Магнитное поле Земли
Презентация на тему Постоянные магниты Магнитное поле Земли  Ломоносов и его вклад в физику
Ломоносов и его вклад в физику Сила
Сила Поляризация диэлектриков
Поляризация диэлектриков