Содержание
- 2. Введение Изучение веществ - достаточно сложное и интересное дело. Ведь в чистом виде они в природе
- 3. Краткая история физико – химического метода анализа Аналитическая химия существует с тех пор, как существует химия
- 4. Первоначально исследования в области физико-химического анализа были сосредоточены на изучении зависимостей температур фазовых переходов от состава.
- 5. Общая характеристика физико – химического метода анализа Физико-химическими называют методы качественного и количественного анализа, основанные на
- 6. Важнейшими физико-химическими методами анализа являются 1) спектральные и другие оптические методы; 2) хроматографические методы; 3) электрохимические
- 7. Наиболее обширной является группа спектральных и других оптических методов анализа, включающая методы эмиссионной спектроскопии, абсорбционной спектроскопии,
- 8. Физико-химические методы анализа имеют следующие достоинства 1) селективность: некоторые методы позволяют одновременно определять десятки компонентов, входящих
- 9. Классификация физико-химических методов анализа Спектральные и оптические методы Электрохимические методы Хроматографические методы Радиометрические методы Масс-спектрометрические методы
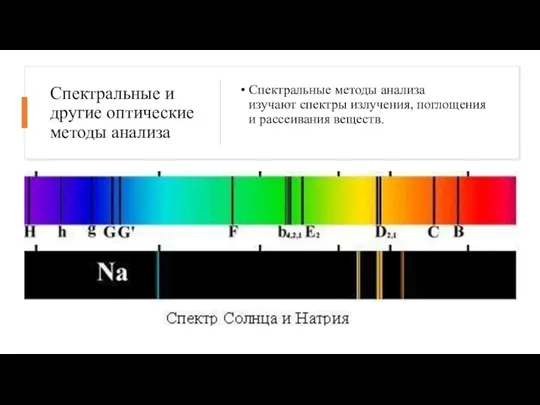
- 10. Спектральные и другие оптические методы анализа Спектральные методы анализа изучают спектры излучения, поглощения и рассеивания веществ.
- 11. К этой группе относятся: 1. Эмиссионный спектральный анализ — изучение эмиссионных спектров элементов вещества. Этим методом
- 12. 3. Спектрофотометрия — определение спектра поглощения или измерения светопоглощения при строго определенной длине волны, которая соответствует
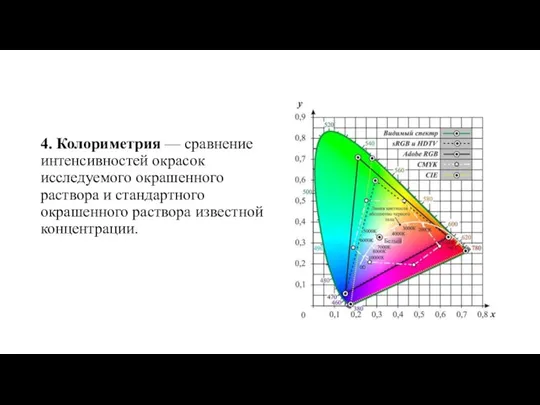
- 13. 4. Колориметрия — сравнение интенсивностей окрасок исследуемого окрашенного раствора и стандартного окрашенного раствора известной концентрации.
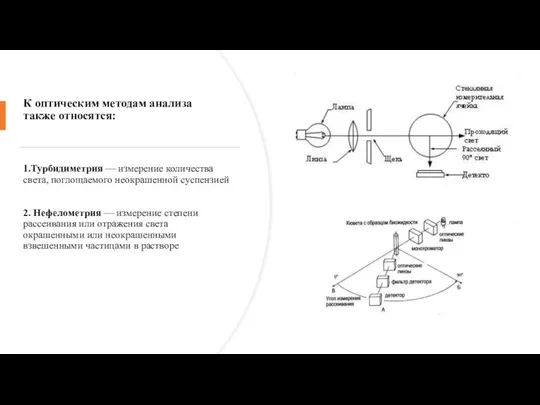
- 14. К оптическим методам анализа также относятся: 1.Турбидиметрия — измерение количества света, поглощаемого неокрашенной суспензией 2. Нефелометрия
- 15. 3. Люминесцентный, или флуоресцентный анализ, основанный на флуоресценции веществ, облученных ультрафиолетовым светом, и измерении интенсивности излучаемого
- 16. 4. Фотометрия пламени — распыление анализируемого раствора в пламени, выделение характерной для данного элемента световой волны
- 17. Электрохимические методы анализа Электрохимические методы анализа - это совокупность методов качественного и количественного анализа, основанных на
- 18. Классификация электрохимических методов анализа: Электрохимические методы анализа классифицируют две группы методов: Методы без наложения внешнего (постороннего)
- 19. Хроматографические методы анализа Хроматография – метод, используемый для разделения компонентов одной пробы, в процессе которого происходит
- 20. Классификация хроматографических методов 1. По агрегатному состоянию подвижной и неподвижной фаз
- 21. Классификация хроматографических методов 2. По механизмам разделения
- 22. Классификация хроматографических методов 3. По применяемой технике анализа: Колоночная хроматография – разделение веществ в специальных колонках
- 23. Классификация хроматографических методов 4. По способам перемещения фаз Проявительный (элюентный) Фронтальный Вытеснительный
- 24. Качественный анализ в хроматографии Качественной характеристикой определяемых веществ являются их времена удерживания (объемы удерживания) и другие
- 25. Количественный анализ в хроматографии Метод абсолютной калибровки предполагает построение градуировочного графика (Si – ci) по стандартным
- 26. Количественный анализ в хроматографии Метод внутреннего стандарта: Хроматографирование эталонных смесей, включающих известные массы определяемого компонента и
- 27. Радиометрические методы анализа Радиометрические методы анализа - Методы, основанные на измерении радиационного спектра излучения исследуемого образца
- 28. Выделяют 2 метода в радиометрии: прямой и активационный Прямой метод. Если природный образец содержит в своем
- 29. Виды излучения α-частицы – это дважды ионизированные ионы Гелия Не2+; β - – поток электронов; β
- 30. Интенсивность излучения – это число радиоактивных распадов в единицу времени. За единицу интенсивности принято 1 кюри
- 31. Масс-спектрометрический метод анализа Масс-спектрометрия - метод исследования и идентификации вещества, позволяющий определять концентрацию различных компонентов в
- 32. Масс-спектральный анализ сводится, в основном, к следующим операциям: Превращение атомов вещества в положительные ионы. Создание ионного
- 33. Этот метод проводится с помощью масс-спектрометра Так выглядел первый в СССР масс-спектрометр
- 34. Потенциометрический метод Потенциометрический метод основан на изменении потенциала электрода в зависимости от физико-химических процессов, протекающих в
- 35. Простейшая потенциометрическая ячейка содержит два электрода: потенциал одного из них прямо или косвенно зависит от концентрации
- 36. Кулонометрический метод Кулонометрическим называют электрохимический метод анализа, основанный на измерении количества электричества, прошедшего через электролитическую ячейку
- 37. Заключение Эффективность и качество продуктов производства в значительной степени определяется научно-обоснованным выбором физико-химических методов исследования. Правильно
- 39. Скачать презентацию

































 Взаимные превращения жидкостей и газов
Взаимные превращения жидкостей и газов Лекция 9. Выпаривание
Лекция 9. Выпаривание Решение задач
Решение задач Потенциальная энергия заряженного тела в однородном электростатическом поле
Потенциальная энергия заряженного тела в однородном электростатическом поле Волны. Энергия переносимая волной
Волны. Энергия переносимая волной Презентация на тему Тепловые двигатели
Презентация на тему Тепловые двигатели  Електромагнітні хвилі. Досліди Герцаі. Теорія Максвелла
Електромагнітні хвилі. Досліди Герцаі. Теорія Максвелла Проактивный анализ состояния трансформаторов на основе технологий big data
Проактивный анализ состояния трансформаторов на основе технологий big data Нанотехнологии в современном мире
Нанотехнологии в современном мире Динамика. Законы Ньютона
Динамика. Законы Ньютона Закон всемирного тяготения. 9 класс
Закон всемирного тяготения. 9 класс Физико-химические методы анализа
Физико-химические методы анализа Lek_02_Elek_22
Lek_02_Elek_22 Система работы учителя по подготовке учащихся к итоговой аттестации по физике
Система работы учителя по подготовке учащихся к итоговой аттестации по физике Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Новые космические двигатели
Новые космические двигатели Диагностика шума подвески кабины
Диагностика шума подвески кабины Физика в игрушках
Физика в игрушках Невидимая сила
Невидимая сила Тепловое действие тока. Закон Джоуля-Ленца
Тепловое действие тока. Закон Джоуля-Ленца Классификация тепловых двигателей
Классификация тепловых двигателей Самоиндукция. Индуктивность
Самоиндукция. Индуктивность Презентация на тему Атом
Презентация на тему Атом  Современные способы и методы контроля и регулировки судовых дизельных двигателей
Современные способы и методы контроля и регулировки судовых дизельных двигателей Электрическое напряжение Или История великого открытия
Электрическое напряжение Или История великого открытия Проводники и диэлектрики в электростатическом поле 10 класс
Проводники и диэлектрики в электростатическом поле 10 класс Решение задач. Мощность
Решение задач. Мощность konspekt (1)
konspekt (1)