Содержание
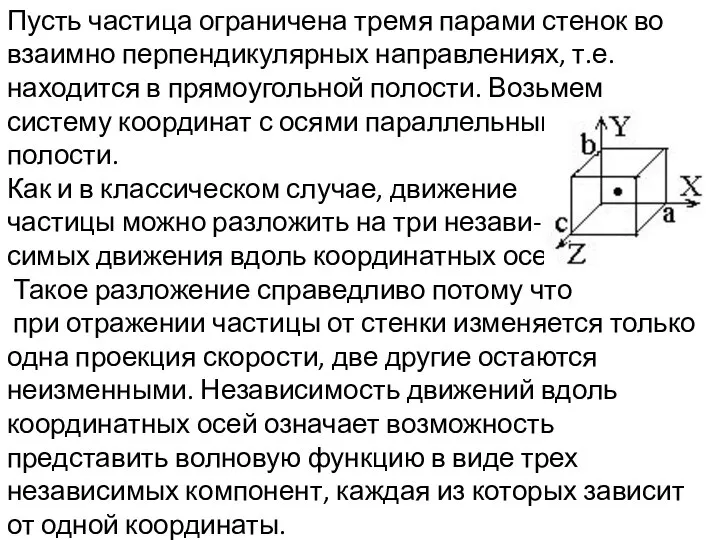
- 3. Пусть частица ограничена тремя парами стенок во взаимно перпендикулярных направлениях, т.е. находится в прямоугольной полости. Возьмем
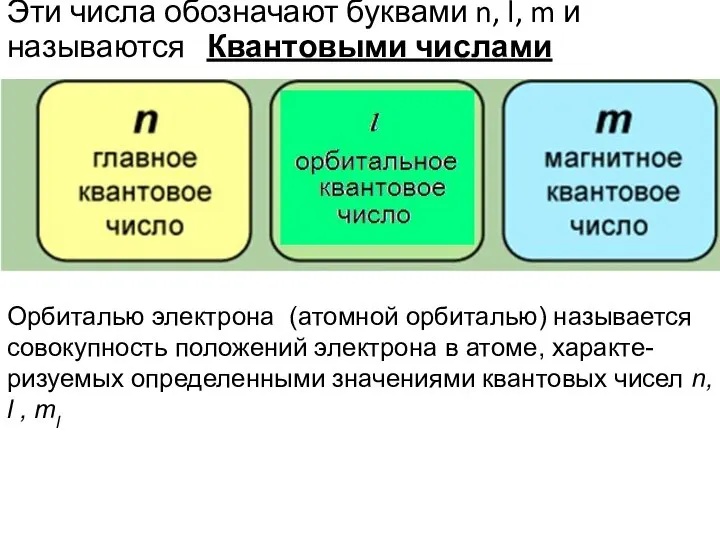
- 7. Эти числа обозначают буквами n, l, m и называются Квантовыми числами Орбиталью электрона (атомной орбиталью) называется
- 8. На рисунке показан график зависимости квадрата модуля радиальной компоненты волновой функции от расстояния –r до ядра.
- 10. Орбитальное квантовое число (l) может прини-мать целочисленные значения, меньшие главного квантового числа – n. Например, если
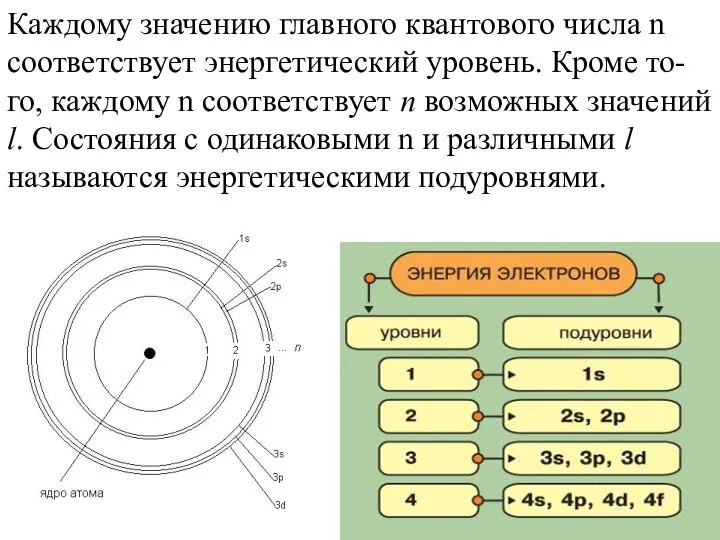
- 11. Каждому значению главного квантового числа n соответствует энергетический уровень. Кроме то-го, каждому n соответствует n возможных
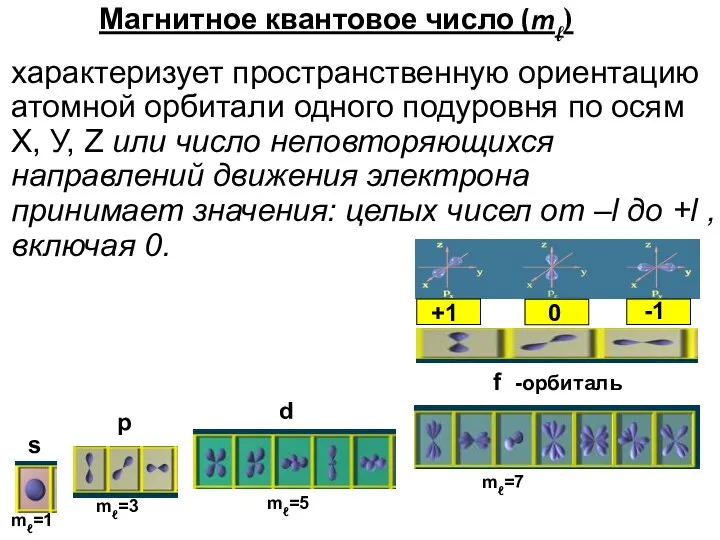
- 12. Магнитное квантовое число (mℓ) характеризует пространственную ориентацию атомной орбитали одного подуровня по осям Х, У, Z
- 13. Для каждого значения l разрешено (2l + 1) значений m. Например, l=4 (f – подуровень). Тогда
- 14. Излучение и поглощение света атомами. Электрон, находящийся на энергетическом уровне выше основного (n>1), может с определенной
- 15. Если фотон испускается в результате перехода между уровнями с энергиями Еn1> и Еn2, то его энергия
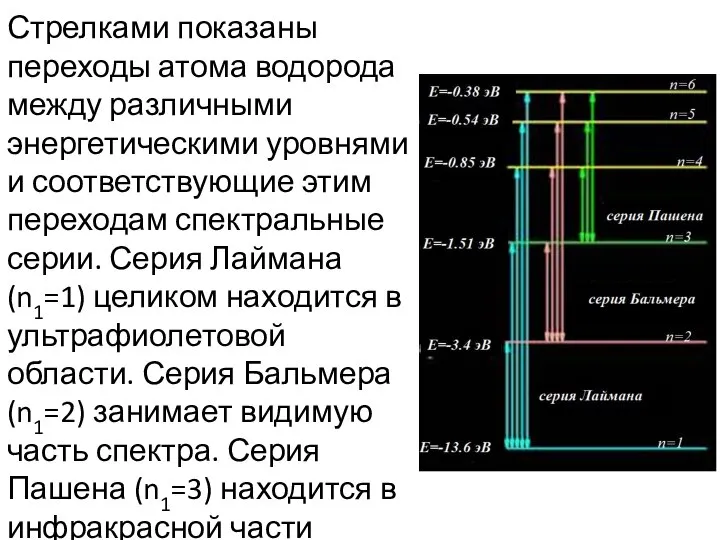
- 17. Стрелками показаны переходы атома водорода между различными энергетическими уровнями и соответствующие этим переходам спектральные серии. Серия
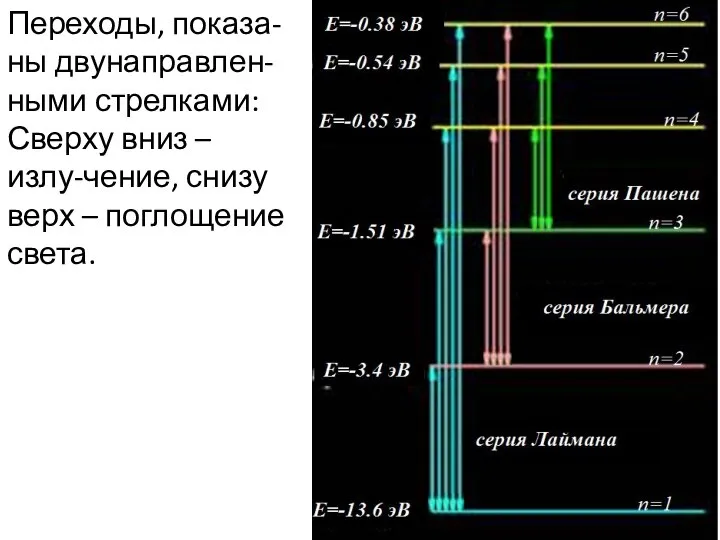
- 18. Переходы, показа-ны двунаправлен-ными стрелками: Сверху вниз – излу-чение, снизу верх – поглощение света.
- 20. Пятиминутка: Рассчитать длины волн в спектре излучения атома водорода, соответствующих переходам серии Бальмера. Постоянную Ридберга для
- 21. Фундаментальные природные закономерности: законы сохранения энергии, импульса, момента импульса являются выражением свойств времени и пространства. Закон
- 22. Аналогичный сюрприз можно ожидать от враща-тельного движения частицы. Ее момент импульса также будет квантован и иногда
- 23. Значение спинового числа (s) определяется свойствами симметрии частицы. Если она абсолютно симметрична, т.е. при повороте на
- 24. С учетом спинового числа состояние электрона в атоме характеризуется 4 квантовыми числами, которые обозначаются n, l,
- 25. При́нцип Па́ули (принцип запрета) - один из фундаментальных принципов законов природы. Два и более тождественных ферми-она
- 26. Рассмотрим строение атомов, опираясь на таблицу Менделеева. Из нее видно, что периоды повторения химических и физических
- 27. Первый период - n = 1. Имеет единственную орбиталь l=0, m=0, на которой могут находиться два
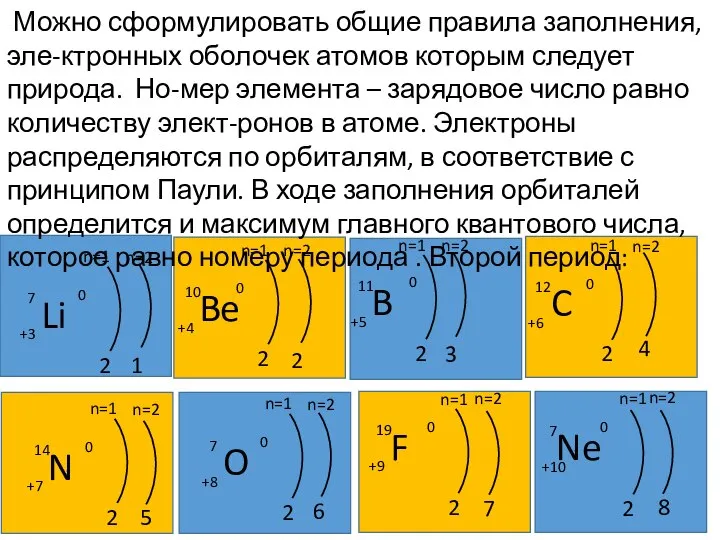
- 28. Можно сформулировать общие правила заполнения, эле-ктронных оболочек атомов которым следует природа. Но-мер элемента – зарядовое число
- 29. Z=3 (литий). Третий электрон лития должен нахо-диться на уровне n=2. Для n=2 возможны два зна-чения орбитального
- 30. n=1 n=2 n=3 1 n=1 n=2 n=3 2 n=1 n=2 n=3 3 n=1 n=2 n=3 4
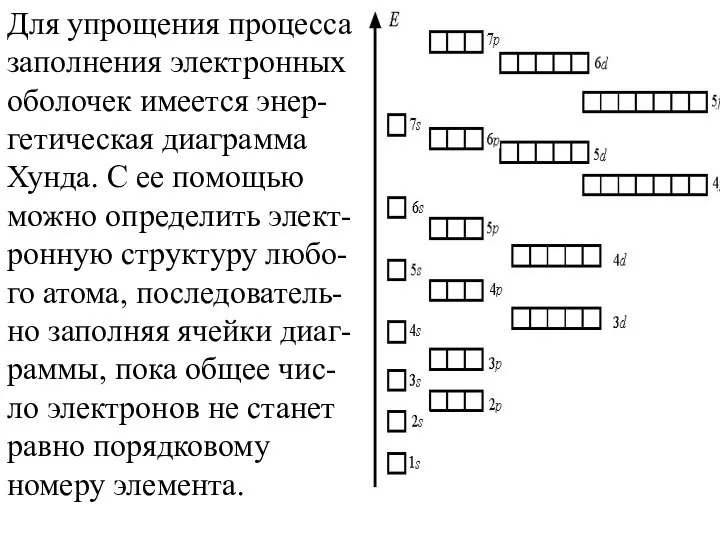
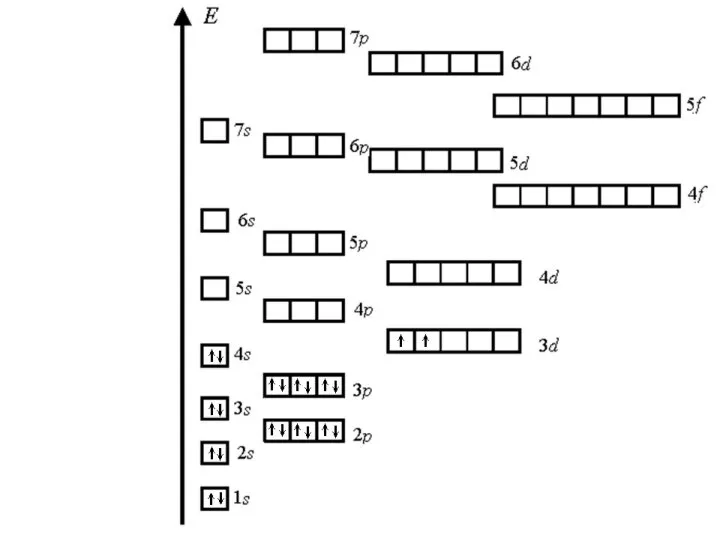
- 31. Для упрощения процесса заполнения электронных оболочек имеется энер-гетическая диаграмма Хунда. С ее помощью можно определить элект-ронную
- 32. Спин электрона в атоме подчиняется правилу Хун-да: Суммарное значение спинового квантового числа электронов данной орбитали должно
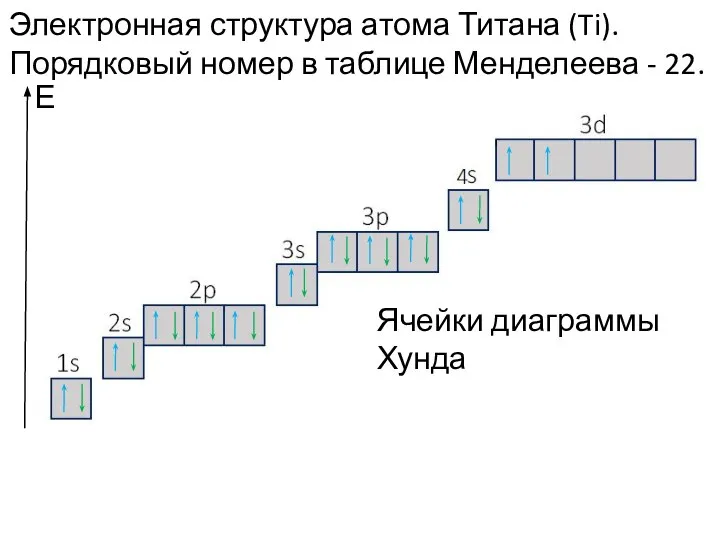
- 34. Электронная структура атома Титана (Ti). Порядковый номер в таблице Менделеева - 22. Е Ячейки диаграммы Хунда
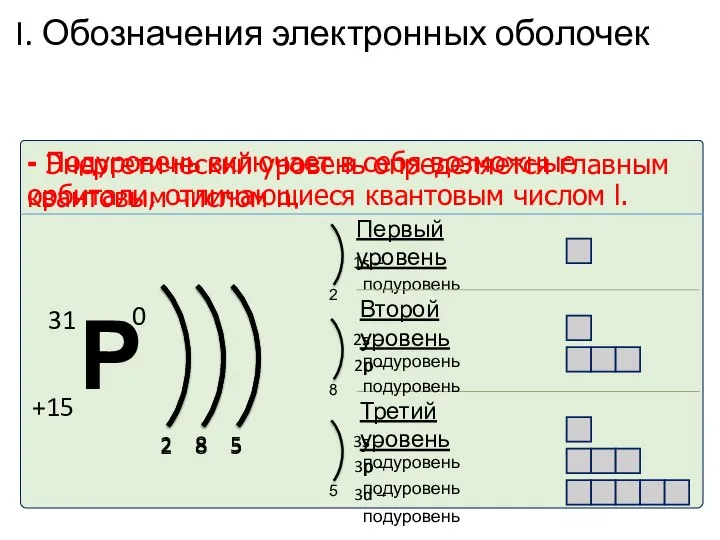
- 35. I. Обозначения электронных оболочек - Энергетический уровень определяется главным квантовым числом n. - Подуровень включает в
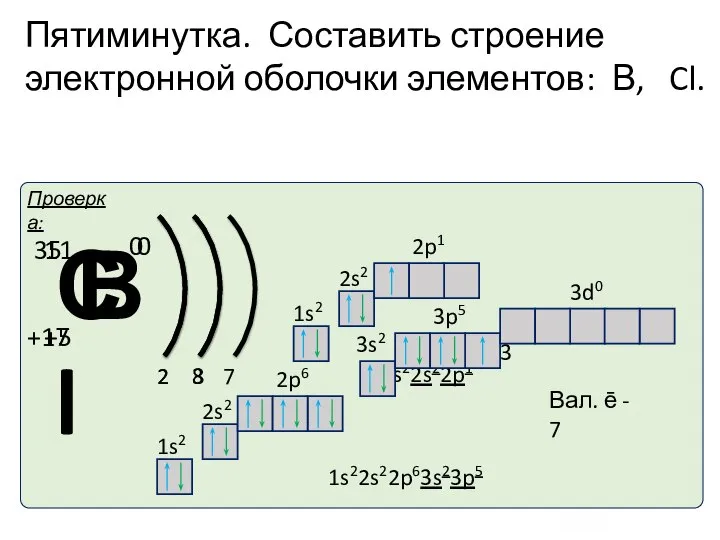
- 36. Пятиминутка. Составить строение электронной оболочки элементов: В, Cl.
- 38. Скачать презентацию























 Лампы ДРЛ (Дуговая Ртутная лампа)
Лампы ДРЛ (Дуговая Ртутная лампа) Токи и напряжения в длинных линиях электропередач
Токи и напряжения в длинных линиях электропередач Линзы. Оптика
Линзы. Оптика Фізичні основи оптикоелектронних систем. Тема 2
Фізичні основи оптикоелектронних систем. Тема 2 ЦАП Цифро-аналоговый преобразователь
ЦАП Цифро-аналоговый преобразователь Закон Джоуля-Ленца. Плотность тока. Скорость движения электронов в проводнике
Закон Джоуля-Ленца. Плотность тока. Скорость движения электронов в проводнике Електричні двигуни
Електричні двигуни Приготовьтесь к построению! Урок физики
Приготовьтесь к построению! Урок физики Методы и приборы для измерения влажности газовых сред
Методы и приборы для измерения влажности газовых сред Действие магнитного поля на проводник с током и движущийся заряд
Действие магнитного поля на проводник с током и движущийся заряд Особенности водно-химического режима в контурах ЯЭУ
Особенности водно-химического режима в контурах ЯЭУ Микромир – мир атомов и элементарных частиц
Микромир – мир атомов и элементарных частиц Выбор тока срабатывания МТЗ
Выбор тока срабатывания МТЗ Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения. Развитие ядерной энергетики
Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения. Развитие ядерной энергетики Характеристики катера Амур-М
Характеристики катера Амур-М Фотоэффект. Применение фотоэффекта
Фотоэффект. Применение фотоэффекта Презентация на тему Свойства твёрдых тел
Презентация на тему Свойства твёрдых тел  Основы антенно-фидерной техники
Основы антенно-фидерной техники Постоянный электрический ток
Постоянный электрический ток Изготовление и изучение дифракционных оптических элементов
Изготовление и изучение дифракционных оптических элементов Импульс тела . Закон сохранения импульсов
Импульс тела . Закон сохранения импульсов Заседание кружка Любители точных наук
Заседание кружка Любители точных наук Электромагнитное поле
Электромагнитное поле Электричество и магнетизм. Курс лекций
Электричество и магнетизм. Курс лекций Подготовка к рубежной контрольной работе по физике в 9-ых классах. Решение задач
Подготовка к рубежной контрольной работе по физике в 9-ых классах. Решение задач Равномерное прямолинейное движение
Равномерное прямолинейное движение Alessandro Volta (1745-1827)
Alessandro Volta (1745-1827) Диэлектрики. Поляризация диэлектриков
Диэлектрики. Поляризация диэлектриков