Слайд 2В 1900 г. М. Планк сформулировал гипотезу квантов энергии: излучение или поглощение

энергии электромагнитных волн атомами вещества происходит не непрерывно, а определенными неделимыми порциями – квантами.
Слайд 3Становление представлений об атоме

Слайд 4Античный период
Атомистика, или учение об атомах, – одна из древнейших областей познания

мира – возникла в античные времена.
«атом» означает «неделимый»
Слайд 5 Демокрит (около 460–370 гг. до н. э.).
1. Из ничего ничто произойти

не может; ничто существующее не может быть уничтожено, и всякое изменение состоит лишь в соединении и разделении.
2. Нет случайности, а всему есть причина и необходимость.
3. Атомы, бесконечные по числу и по форме, своим движением, столкновением и возникающим оттого круговращением образуют видимый мир.
4. Различие предметов зависит только от различия числа, формы и порядка атомов, из которых они образованы.
Слайд 6XVIII-XIX века
Дж. Дальтон
Английский ученый приписал атому количественную «мерку»
– относительный вес.

Слайд 7
Но по-прежнему оставался неразрешимым сакраментальный вопрос: что же представляет собой атом?

Слайд 8Менделеев:
1. Химические атомы каждого элемента неизменны.
2. Видов атомов столько, сколько есть химических

элементов (на 1892 г. – около 70).
3. Все атомы данного элемента одинаковы.
4. Атомы имеют вес – несомненно различие (относительного) веса атомов различных элементов.
Слайд 9ХХ век
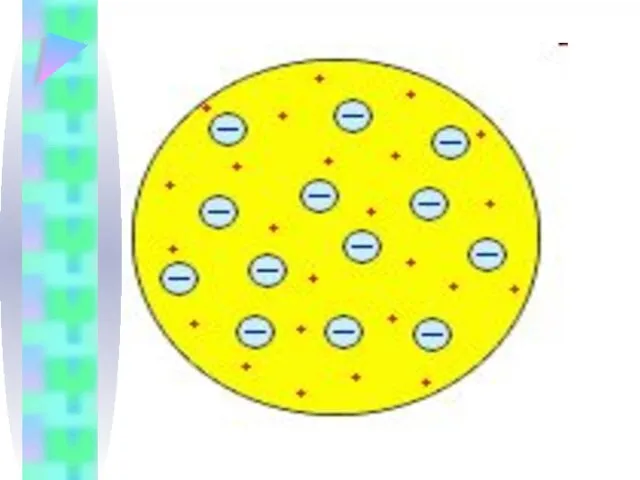
Модель атома Томсона
Первую модель атома в 1903 г. предложил Джозеф Джон

Томсон (1856 – 1940), создав ее вскоре после открытия им же в 1895 – 1897 гг. электрона.
Слайд 11 Д.Томсон. английский физик, один из создателей учения о радиоактивности и строении атома,

основатель научной школы, Открыл (1899) альфа- и бета-лучи и установил их природу.
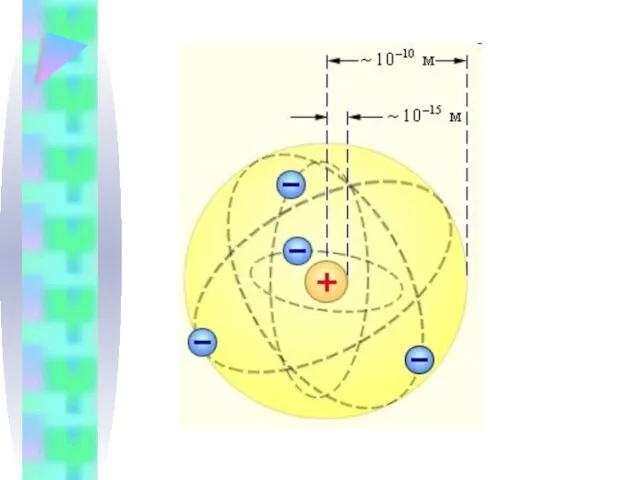
Слайд 122. Модель атома Резерфорда
Резерфорд построил планетарную модель атома.

Слайд 13 Резерфорд Эрнст (1871-1937), английский физик, один из создателей учения о радиоактивности и

строении атома, основатель научной школы, иностранный член-корреспондент РАН (1922) и почетный член АН СССР (1925)
Слайд 14
Главный недостаток модели Резерфорда:
НЕСТАБИЛЬНОСТЬ!
ē должен упасть через 10-10 с
и непрерывно излучать

Слайд 16Модель атома Бора
1913 г. датский физик
Нильс Хенрик Давид Бор.
Модель Бора

опиралась на квантовую гипотезу.
Слайд 17 Бор, Нильс Хенрик Давид (1885-1962),датский физик, лауреат Нобелевской премии по физике 1922,

присужденной за создание квантовой теории строения атома.
Слайд 19 Постулаты Бора:
1. Атом может существовать в стационарном состоянии, не испуская и не

поглощая электромагнитного излучения (электроны движутся по определенным устойчивым орбитам),
2. При переходе атома из одного стационарного состояния в другое, он излучает или поглощает порцию Е
Слайд 20Атом – наименьшая частица химического элемента, входящая в состав молекул простых и

сложных веществ.
Атом – электронейтрален
Слайд 21атомное ядро (размер 10-12 см) состоит из протонов и нейтронов, вся масса

атома сосредоточена в ядре.
Слайд 22число электронов соответствует порядковому номеру химического элемента в периодической системе и числу

протонов в ядре
Слайд 23электроны наружного слоя (валентные) менее прочно связанны с ядром и могут отрываться

от атома и присоединяться к другим атомам, образуя катионы и анионы
Слайд 24В начале 20 в. в науке складывается представление о противопоставлении 2-х видов

материи - вещества и поля:
Слайд 25корпускулярная концепция - материя состоит из частиц (атомов),
в т.ч. свет –

поток корпускул
Слайд 26континуальная концепция - материя – непрерывное электромагнитное поле

Слайд 27корпускулярно-волновой дуализм – универсальное свойство природы, когда всем микрообъектам присущи одновременно и

корпускулярные, и волновые характеристики
Слайд 28особенностей поведения микрочастиц:
корпускулярно-волновая природа
взаимопревращаемость частиц и переход вещества в излучение

Слайд 293. местоположение и импульс частицы можно предсказать только с определенной вероятностью.
4. точное

измерение возможно только при потоке частиц.

























 Электрический ток в различных средах
Электрический ток в различных средах Подсчёт запасов нефти объёмным методом. Задание 1 (часть 1)
Подсчёт запасов нефти объёмным методом. Задание 1 (часть 1) Электромагнитные колебания и волны
Электромагнитные колебания и волны Механика деформируемого твердого тела
Механика деформируемого твердого тела Изучение тепловых явлений
Изучение тепловых явлений Методы и приборы для измерения структурно-механических свойств пищевых продуктов
Методы и приборы для измерения структурно-механических свойств пищевых продуктов Квантовая биофизика
Квантовая биофизика Регулировка клапанов цилиндра
Регулировка клапанов цилиндра Техническое обслуживание и текущий ремонт двигателя, системы охлаждения и смазки Toyota Mark II
Техническое обслуживание и текущий ремонт двигателя, системы охлаждения и смазки Toyota Mark II Игра-путешествие Физика – это интересно!
Игра-путешествие Физика – это интересно! Физический КВН
Физический КВН 5 1 Диффузия
5 1 Диффузия Разработка модели и исследование процессов в электроприводе постоянного тока
Разработка модели и исследование процессов в электроприводе постоянного тока Презентация на тему Тепловое движение атомов и молекул
Презентация на тему Тепловое движение атомов и молекул  Простые и сложные вещества
Простые и сложные вещества Механическое движение. Движется или не движется?
Механическое движение. Движется или не движется? Химические источники тока. Хит в будущем
Химические источники тока. Хит в будущем prez_L3
prez_L3 Расчет стоимости электрической энергии
Расчет стоимости электрической энергии Принцип работы 4-х тактного дизельного двигателя
Принцип работы 4-х тактного дизельного двигателя Презентация на тему Оптические явления в атмосфере
Презентация на тему Оптические явления в атмосфере  Расчет изгибаемых элементов по наклонным сечениям
Расчет изгибаемых элементов по наклонным сечениям Статические характеристики элементов автоматики
Статические характеристики элементов автоматики Кинематика точки
Кинематика точки Исследование воздействия волн на большие плавучие сооружения
Исследование воздействия волн на большие плавучие сооружения Презентация на тему Плавление и кристаллизация
Презентация на тему Плавление и кристаллизация  Теплотехнические измерения
Теплотехнические измерения Молекулярная физика
Молекулярная физика