Содержание
- 2. I NUMERI QUANTICI Il numero quantico principale n indica il livello energetico e la dimensione degli
- 3. NUMERO QUANTICO SECONDARIO Nel 1915 Sommerfeld ampliò il modello di Bohr aggiungendo altre orbite quantizzate ellittiche.
- 4. NUMERO QUANTICO SECONDARIO Per l = 1 l'orbitale è a due lobi (orbitale p). Il nucleo
- 5. NUMERO QUANTICO SECONDARIO Per l = 2 l'orbitale è a quattro lobi (orbitale d). Il nucleo
- 6. NUMERO QUANTICO MAGNETICO Il numero quantico magnetico m, indica il numero di orientazioni di un dato
- 7. NUMERO QUANTICO DI SPIN Nel novembre del 1925 due fisici olandesi, G.E. Uhlenbeck e S.A. Goudsmit,
- 8. NUMERI QUANTICI (Riepilogo )
- 10. Скачать презентацию
Слайд 2I NUMERI QUANTICI
Il numero quantico principale n indica il livello energetico e la dimensione
I NUMERI QUANTICI
Il numero quantico principale n indica il livello energetico e la dimensione

Il numero quantico principale può assumere soltanto i valori interi 1, 2, 3, 4, 5, 6, 7.
Quando il valore del numero quantico principale cresce, gli orbitali diventano più grandi, la loro energia aumenta e gli elettroni sono più lontani dal nucleo.
Tutti gli orbitali che sono caratterizzati dallo stesso valore di n appartengono allo stesso livello di energia.
Il numero massimo di elettroni presenti nel livello n è pari a 2·n2. In realtà questo è valido per i primi 4 livelli. Quindi:
nel primo livello di energia (n = 1) ci potranno essere al massimo 2·12 = 2 elettroni
nel secondo livello di energia (n = 2) ci potranno essere al massimo 2·22 = 8 elettroni
nel terzo livello di energia (n = 3) ci potranno essere al massimo 2·32 = 18 elettroni
nel quarto livello di energia (n = 4) ci potranno essere al massimo 2·42 = 32 elettroni
NUMERO QUANTICO PRINCIPALE
n
4
3
2
1
5
6
7
Energia crescente
N
M
L
K
O
P
Q
2
8
18
32
21
9
2
Numero massimo di elettroni per livello = 2·n2
Слайд 3NUMERO QUANTICO SECONDARIO
Nel 1915 Sommerfeld ampliò il modello di Bohr aggiungendo altre
NUMERO QUANTICO SECONDARIO
Nel 1915 Sommerfeld ampliò il modello di Bohr aggiungendo altre
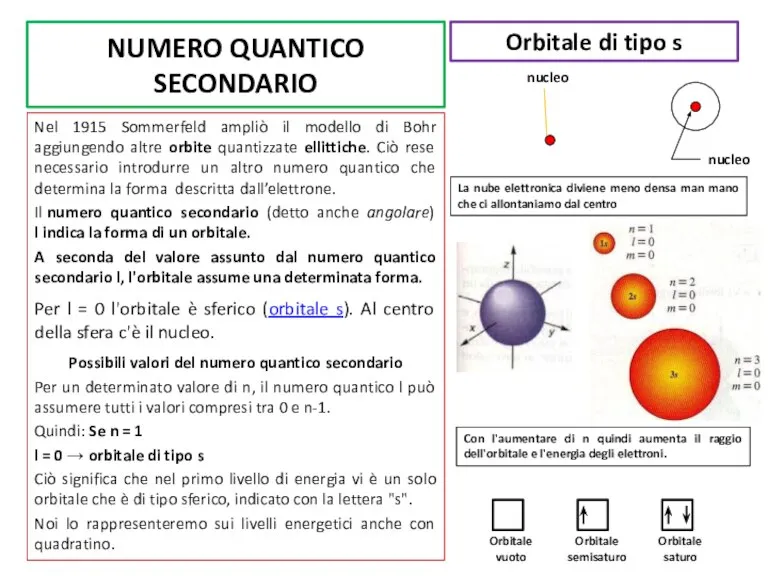
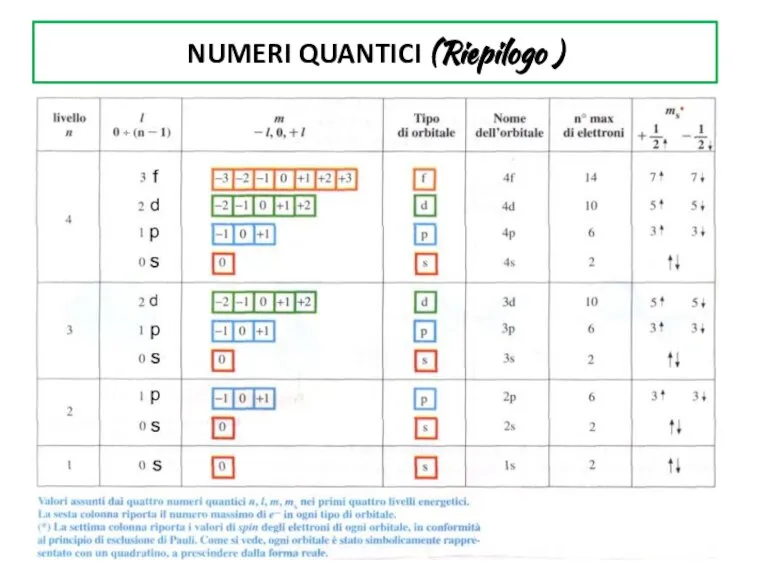
Il numero quantico secondario (detto anche angolare) l indica la forma di un orbitale.
A seconda del valore assunto dal numero quantico secondario l, l'orbitale assume una determinata forma.
Per l = 0 l'orbitale è sferico (orbitale s). Al centro della sfera c'è il nucleo.
Possibili valori del numero quantico secondario
Per un determinato valore di n, il numero quantico l può assumere tutti i valori compresi tra 0 e n-1.
Quindi: Se n = 1
l = 0 → orbitale di tipo s
Ciò significa che nel primo livello di energia vi è un solo orbitale che è di tipo sferico, indicato con la lettera "s".
Noi lo rappresenteremo sui livelli energetici anche con quadratino.
Orbitale di tipo s
Con l'aumentare di n quindi aumenta il raggio dell'orbitale e l'energia degli elettroni.
La nube elettronica diviene meno densa man mano che ci allontaniamo dal centro
Слайд 4NUMERO QUANTICO SECONDARIO
Per l = 1 l'orbitale è a due lobi (orbitale
NUMERO QUANTICO SECONDARIO
Per l = 1 l'orbitale è a due lobi (orbitale
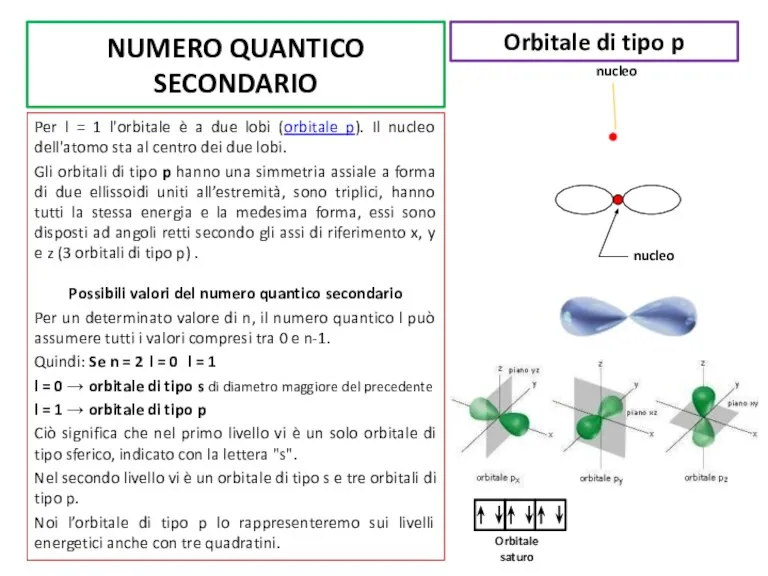
Gli orbitali di tipo p hanno una simmetria assiale a forma di due ellissoidi uniti all’estremità, sono triplici, hanno tutti la stessa energia e la medesima forma, essi sono disposti ad angoli retti secondo gli assi di riferimento x, y e z (3 orbitali di tipo p) .
Possibili valori del numero quantico secondario
Per un determinato valore di n, il numero quantico l può assumere tutti i valori compresi tra 0 e n-1.
Quindi: Se n = 2 l = 0 l = 1
l = 0 → orbitale di tipo s di diametro maggiore del precedente
l = 1 → orbitale di tipo p
Ciò significa che nel primo livello vi è un solo orbitale di tipo sferico, indicato con la lettera "s".
Nel secondo livello vi è un orbitale di tipo s e tre orbitali di tipo p.
Noi l’orbitale di tipo p lo rappresenteremo sui livelli energetici anche con tre quadratini.
Orbitale di tipo p
Слайд 5NUMERO QUANTICO SECONDARIO
Per l = 2 l'orbitale è a quattro lobi (orbitale
NUMERO QUANTICO SECONDARIO
Per l = 2 l'orbitale è a quattro lobi (orbitale
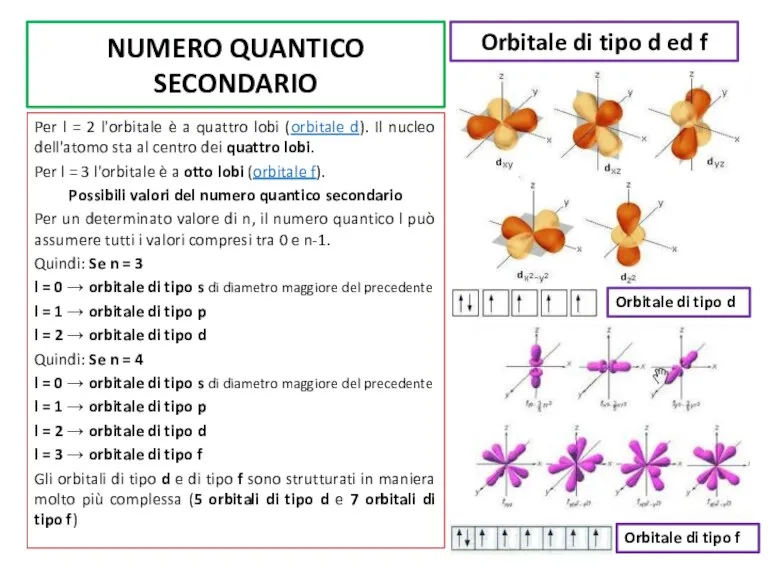
Per l = 3 l'orbitale è a otto lobi (orbitale f).
Possibili valori del numero quantico secondario
Per un determinato valore di n, il numero quantico l può assumere tutti i valori compresi tra 0 e n-1.
Quindi: Se n = 3
l = 0 → orbitale di tipo s di diametro maggiore del precedente
l = 1 → orbitale di tipo p
l = 2 → orbitale di tipo d
Quindi: Se n = 4
l = 0 → orbitale di tipo s di diametro maggiore del precedente
l = 1 → orbitale di tipo p
l = 2 → orbitale di tipo d
l = 3 → orbitale di tipo f
Gli orbitali di tipo d e di tipo f sono strutturati in maniera molto più complessa (5 orbitali di tipo d e 7 orbitali di tipo f)
Orbitale di tipo d
Orbitale di tipo d ed f
Orbitale di tipo f
Слайд 6NUMERO QUANTICO MAGNETICO
Il numero quantico magnetico m, indica il numero di orientazioni
NUMERO QUANTICO MAGNETICO
Il numero quantico magnetico m, indica il numero di orientazioni
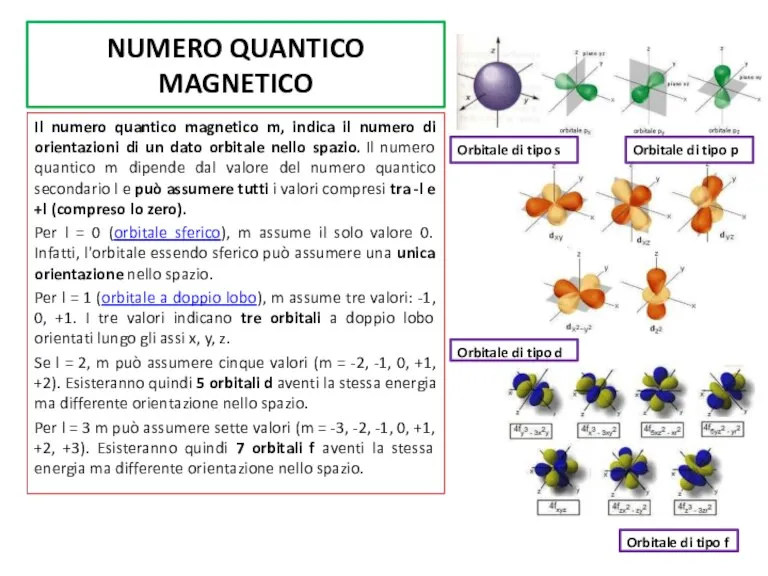
Per l = 0 (orbitale sferico), m assume il solo valore 0. Infatti, l'orbitale essendo sferico può assumere una unica orientazione nello spazio.
Per l = 1 (orbitale a doppio lobo), m assume tre valori: -1, 0, +1. I tre valori indicano tre orbitali a doppio lobo orientati lungo gli assi x, y, z.
Se l = 2, m può assumere cinque valori (m = -2, -1, 0, +1, +2). Esisteranno quindi 5 orbitali d aventi la stessa energia ma differente orientazione nello spazio.
Per l = 3 m può assumere sette valori (m = -3, -2, -1, 0, +1, +2, +3). Esisteranno quindi 7 orbitali f aventi la stessa energia ma differente orientazione nello spazio.
Orbitale di tipo d
Orbitale di tipo f
Orbitale di tipo p
Orbitale di tipo s
Слайд 7NUMERO QUANTICO DI SPIN
Nel novembre del 1925 due fisici olandesi, G.E. Uhlenbeck
NUMERO QUANTICO DI SPIN
Nel novembre del 1925 due fisici olandesi, G.E. Uhlenbeck

Inoltre, poiché l'elettrone possiede anche una carica elettrica, il suo movimento a trottola gli conferiva un'altra proprietà, quella cioè di una minuscola calamita con polo nord e polo sud.
Per descrivere l'orientazione del vettore di spin dell'elettrone, fu definito quindi un quarto numero quantico che, simboleggiato con ms, prese il nome di numero quantico di spin e può assumere soltanto due valori:
ms = + ½ e ms = - ½
Ciascun valore corrisponde a una rotazione in senso orario o in senso antiorario dell’elettrone attorno al proprio asse. Se ruota in senso orario si indica con una freccia verso l’alto (spin su) [ ↑ ], se ruota in senso antiorario la freccia sarà rivolta verso il basso (spin giù) [ ↓ ].
Слайд 8NUMERI QUANTICI (Riepilogo )
NUMERI QUANTICI (Riepilogo )
 Презентация на тему Трансформаторы (11 класс)
Презентация на тему Трансформаторы (11 класс)  Леонардо да Винчи, его вклад в развитие механики
Леонардо да Винчи, его вклад в развитие механики Анализ методов повышения КПД судовой пароэнергетической установки
Анализ методов повышения КПД судовой пароэнергетической установки Электронные компоненты
Электронные компоненты Презентация на тему Кинетическая и потенциальная энергия
Презентация на тему Кинетическая и потенциальная энергия  Физические основы функционирования пневмосистем. Тема 1.1
Физические основы функционирования пневмосистем. Тема 1.1 Ускорение свободного падения на Земле и других небесных телах
Ускорение свободного падения на Земле и других небесных телах Физика атома, атомного ядра и элементарных частиц
Физика атома, атомного ядра и элементарных частиц Наноматериалы. Оптические свойства
Наноматериалы. Оптические свойства Ламповый генератор
Ламповый генератор Double - beta decay of 96zr and double - electron capture of 156dy to excited final states
Double - beta decay of 96zr and double - electron capture of 156dy to excited final states Типология современного урока (ФГОС)
Типология современного урока (ФГОС) Ядерный реактор
Ядерный реактор Презентация на тему Энергосбережение в быту (8 класс)
Презентация на тему Энергосбережение в быту (8 класс)  Исследование эксплуатационных характеристик энергетической установки с ДВС 2Ч 8,5х11 при работе в газодизельном цикле
Исследование эксплуатационных характеристик энергетической установки с ДВС 2Ч 8,5х11 при работе в газодизельном цикле Глаз. Особенности зрения человека
Глаз. Особенности зрения человека Измеряем площадь взвешиванием
Измеряем площадь взвешиванием Самоіндукція. Індуктивність. Енергія магнітного поля
Самоіндукція. Індуктивність. Енергія магнітного поля Презентация на тему Плавление
Презентация на тему Плавление  Презентация на тему Магнитные свойства вещества
Презентация на тему Магнитные свойства вещества  Цикл Карно и цикл Ренкина для паросиловой установки
Цикл Карно и цикл Ренкина для паросиловой установки Эффект Кайе Kaye effect
Эффект Кайе Kaye effect Аэродинамика Т 5-1
Аэродинамика Т 5-1 Определение высоты отскока шарика для настольного тенниса. Превращение и сохранение энергии. 7 класс
Определение высоты отскока шарика для настольного тенниса. Превращение и сохранение энергии. 7 класс Презентация на тему Вещества в электрическом поле
Презентация на тему Вещества в электрическом поле  лекция 4_дифр Фраунгофера на ДР
лекция 4_дифр Фраунгофера на ДР Условия плавания тел
Условия плавания тел ТMM структура. Лекция 1
ТMM структура. Лекция 1