Слайд 2Основные понятия
Молекула- мельчайшая частица вещества, обладающая всеми его свойствами
Атом - частица вещества микроскопических

размеров и массы, наименьшая часть химического элемента, являющаяся носителем его свойств.
Идеальный газ - теоретическая модель газа.
Пренебрегается взаимодействием частиц газа (средняя кинетическая энергия частиц много больше энергии их взаимодействия)
Слайд 3Основные понятия
Диффузия - процесс взаимного проникновения молекул или атомов одного вещества между молекулами

или атомами другого при взаимном соприкосновении.
Броуновское движение- беспорядочное движение микроскопических видимых, взвешенных в жидкости или газе частиц твердого вещества, вызываемое тепловым движением частиц жидкости или газа.
Слайд 5Основные понятия
1 моль— это количество вещества, содержащее столько молекул, атомов, ионов, электронов или

других структурных единиц, сколько содержится атомов в 12 граммах углерода
Молекулярная масса- (Mr) – это число, показывающее во сколько раз масса данного вещества больше массы 1/12 атома углерода.
Молярная масса- масса 1 моля вещества
Слайд 6Основные понятия
Абсолютный нуль температуры –минимальный теоретический предел температуры, который может иметь физическое

тело.
t= - 273,15 0С соответствует Т = 0 К
NA=6•1023 1/моль, (число Авогадро)
k= 1,38•10 -23 Дж/К (пост. Больцмана)
R= 8,31 Дж/моль К (газовая постоянная)
Слайд 7Молекулярная физика
Основные положения МКТ:
1. Все тела (вещества) состоят из частиц между которыми

есть промежутки.
2. Частицы находятся в постоянном, беспорядочном движении.
3. Частицы вещества взаимодействуют друг с другом: притягиваются на небольших расстояниях и отталкиваются, когда эти расстояния уменьшаются
Слайд 9Молекулярная физика
Связь температурных шкал: T=273+t

Слайд 13Газовые законы
Бойля-Мариотта
T=const; p1V1=p2V2
Изотермический
Слайд 17Термодинамика
1 закон термодинамики:
ΔU= Q + A Внутреннюю энергию можно изменить передачей

теплоты (теплопроводность, конвекция, излучение) или совершением работы.
Q= ΔU + A΄ Количество теплоты, переданное системе идет на изменение внутренней энергии и на совершение работы.
где А – работа, совершенная над газом (газ сжали), A΄– работа газа (газ расширился)
Слайд 18Термодинамика
Площадь фигуры под графиком давления численно равна работе

Слайд 19Термодинамика
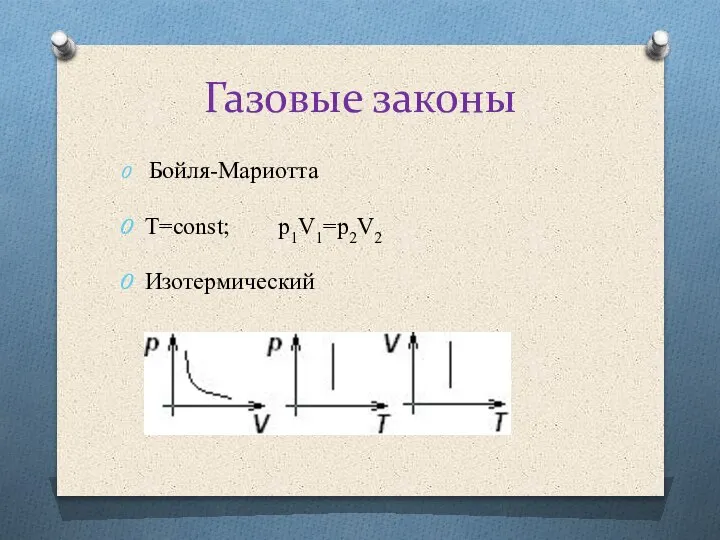
Применение 1 закона термодинамики к изопроцессам:
1. Изотермический: T= const, ΔT=0,

Q=A΄
(вся теплота идет на совершение работы)
2. Изобарный: p=const, ,
Q=5/2νRT, Q= 5/2 pΔV
3. Изохорный: V=const, ΔV=0, A΄ =0,
Q = ΔU
(Вся теплота идет на изменение внутренней энергии).
4. Адиабатный: (процесс, происходящий без теплообмена с окружающей средой) Q=0,
A΄ = - ΔU
(Работа совершается за счет уменьшения внутренней энергии)
Слайд 22Агрегатные состояния вещества
АВ –нагревание твердого тела, в кристаллической решетке молекулы колеблются

интенсивнее.
ВС – плавление, разрушается кристаллическая решетка. CD- нагревание жидкости, молекулы жидкости движутся быстрее.
DE-испарение при кипении, молекулы покидают жидкость. ЕF- нагревание пара, молекулы пара движутся быстрее. FMNKTP – обратный процесс: остывание пара, конденсация, остывание жидкости, кристаллизация, остывание твердого тела.
Слайд 23Агрегатные состояния вещества
Нагревание(остывание) ,
Q = cm Δt,
с

– удельная теплоемкость – количество теплоты, необходимое для нагревания 1 кг вещества на 10С (1К)
Плавление (кристаллизация)
Q = ± λm ,
λ –удельная теплота плавления – количество теплоты, необходимое для плавления 1 кг кристаллического вещества, взятого при температуре плавления
Испарение (конденсация)
Q = ± r m
r - удельная теплота испарения – количество теплоты, необходимое для испарения1 кг жидкости, взятой при температуре кипения
























 Фундаментальные физические величины. Упражнения. Часть 2
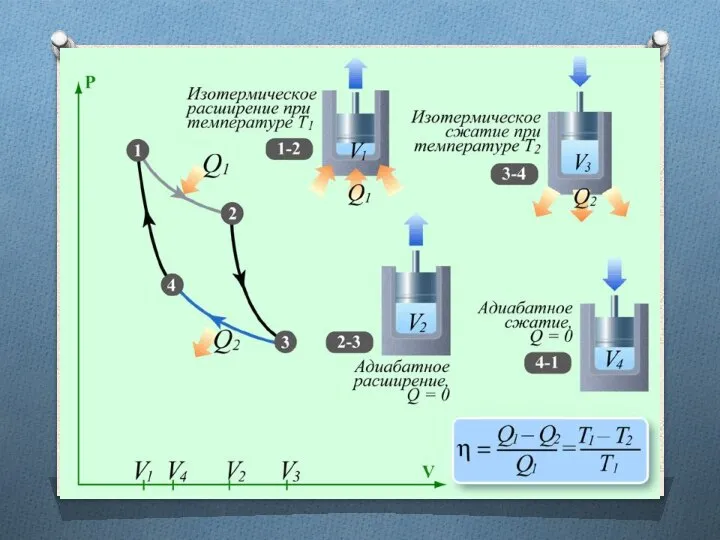
Фундаментальные физические величины. Упражнения. Часть 2 Презентация урока физики в 8 классе «Параллельное соединение проводников ». Автор: Глазунова Лидия Ивановна, учитель физики МБО
Презентация урока физики в 8 классе «Параллельное соединение проводников ». Автор: Глазунова Лидия Ивановна, учитель физики МБО Электростатика. Сила Кулона
Электростатика. Сила Кулона Виды излучений. Источники света
Виды излучений. Источники света Основное оборудовние тепловых насосов
Основное оборудовние тепловых насосов Электрические машины. Вращающееся магнитное поле. Трехфазные асинхронные двигатели
Электрические машины. Вращающееся магнитное поле. Трехфазные асинхронные двигатели Сверхпроводимость. ВТСП структуры
Сверхпроводимость. ВТСП структуры Урок-конференция
Урок-конференция Закон Ома для последовательной электрической цепи переменного тока, содержащей активное и реактивное сопротивления
Закон Ома для последовательной электрической цепи переменного тока, содержащей активное и реактивное сопротивления Магнитное поле. Лекция 19. Закон Био-Савара-Лапласа. Теорема о циркуляции вектора магнитной индукции
Магнитное поле. Лекция 19. Закон Био-Савара-Лапласа. Теорема о циркуляции вектора магнитной индукции Ядерный реактор
Ядерный реактор Интегральные параметры переменного напряжения
Интегральные параметры переменного напряжения Двигуни внутрішнього згоряння
Двигуни внутрішнього згоряння Физика в картинках. Пирамиды в Гизе
Физика в картинках. Пирамиды в Гизе Что изучает физика
Что изучает физика Презентация на тему Электрические явления
Презентация на тему Электрические явления  Обратные задачи определения источника в уравнении теплопроводности
Обратные задачи определения источника в уравнении теплопроводности Ультразвук
Ультразвук Световое давление Урок для 11 класса.
Световое давление Урок для 11 класса. Изгиб. Основные понятия. Классификация видов изгибов
Изгиб. Основные понятия. Классификация видов изгибов Необходимость создания приемной антенно цифровой решетки для ультразвуковой безэховой камеры
Необходимость создания приемной антенно цифровой решетки для ультразвуковой безэховой камеры Параллельная работа одинаковых трубопроводов
Параллельная работа одинаковых трубопроводов قانون گاوس :کل شار الکتریکی که از یک سطح بسته عبور میکند،
قانون گاوس :کل شار الکتریکی که از یک سطح بسته عبور میکند، Основные понятия электродинамики
Основные понятия электродинамики Демонтаж тормозной системы автомобиля
Демонтаж тормозной системы автомобиля Презентация на тему Энергосбережение в быту (8 класс)
Презентация на тему Энергосбережение в быту (8 класс) 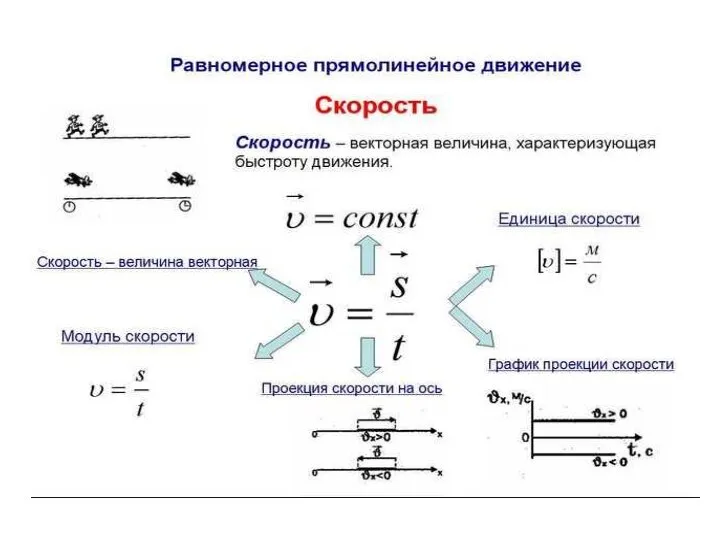 Равномерное прямолинейное движение
Равномерное прямолинейное движение Презентация по физике "Расчет стоимости электроэнергии. Электроприборы в быту. Техника электробезопасности" -
Презентация по физике "Расчет стоимости электроэнергии. Электроприборы в быту. Техника электробезопасности" -