Содержание
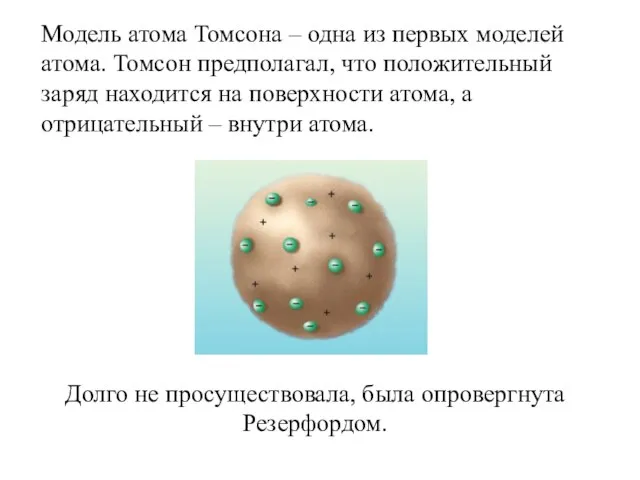
- 2. Модель атома Томсона – одна из первых моделей атома. Томсон предполагал, что положительный заряд находится на
- 3. Планетарная (ядерная) модель атома В 1911 г английский физик Э.Резерфорд предложил планетарную модель атома.
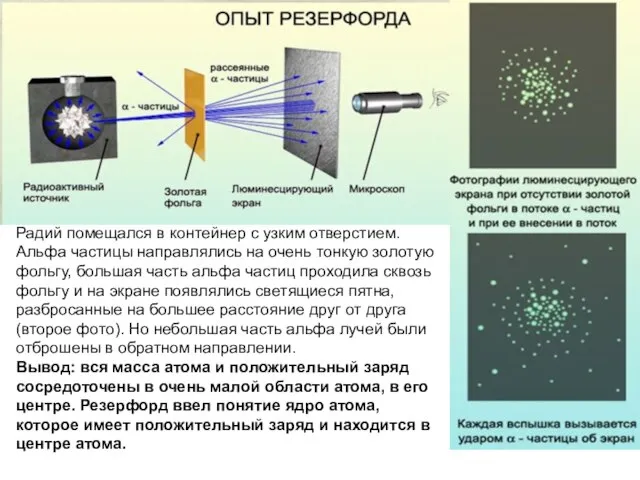
- 4. Радий помещался в контейнер с узким отверстием. Альфа частицы направлялись на очень тонкую золотую фольгу, большая
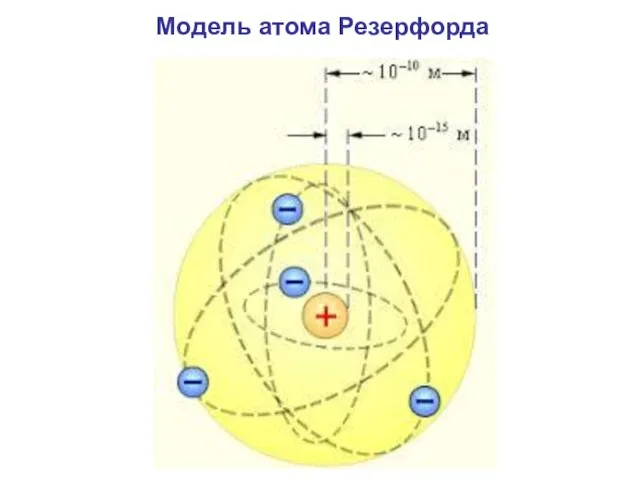
- 5. Модель атома Резерфорда
- 6. В центре атома – положительно заряженная частица – ядро. Заряд ядра: qя = +Z·e Z- порядковый
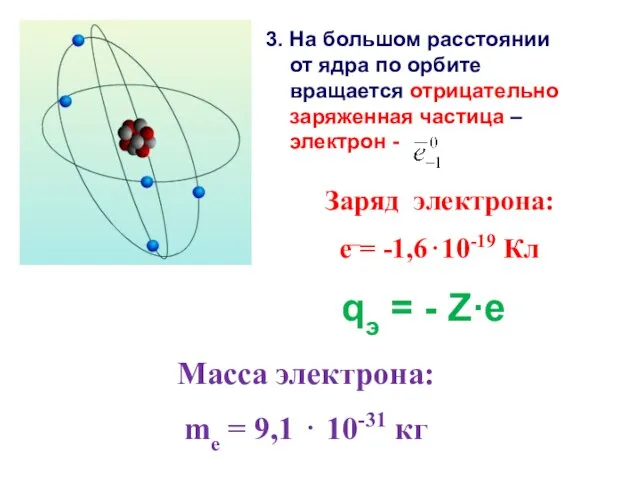
- 7. 3. На большом расстоянии от ядра по орбите вращается отрицательно заряженная частица – электрон - Заряд
- 8. В обычном состоянии атом нейтрален. Потому что, количество протонов в ядре атома любого элемента равно количеству
- 9. Нейтроны вместе с протонами называются нуклонами. Ядро называется нуклид. AZХ – произвольный химический элемент где А
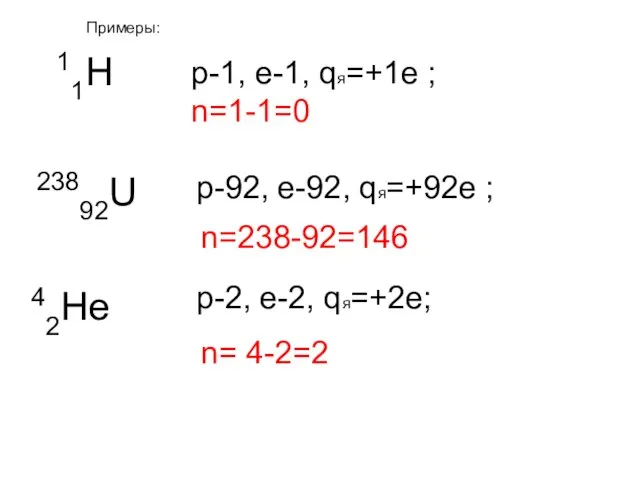
- 10. 11Н 23892U 42He p-1, e-1, qя=+1e ; n=1-1=0 p-92, e-92, qя=+92e ; p-2, e-2, qя=+2e; n=238-92=146
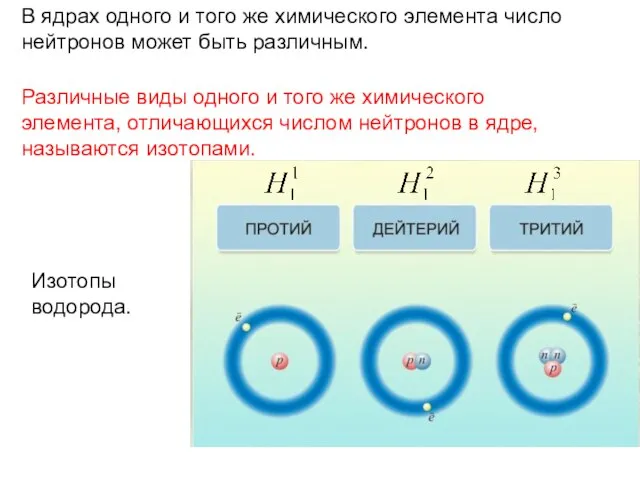
- 11. В ядрах одного и того же химического элемента число нейтронов может быть различным. Различные виды одного
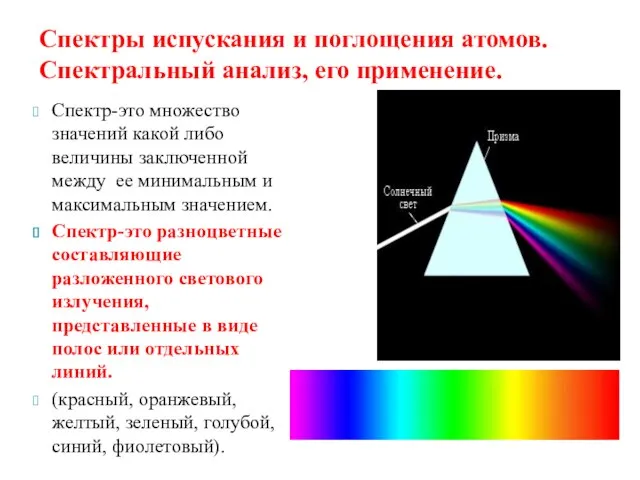
- 12. Спектр-это множество значений какой либо величины заключенной между ее минимальным и максимальным значением. Спектр-это разноцветные составляющие
- 13. Непрерывные спектры дают тела, находящиеся в твердом , жидком состоянии, а также сильно сжатые газы. Линейчатые
- 14. Атомы любого химического элемента излучают строго определенный набор длин волн, дают спектр, не похожий на спектры
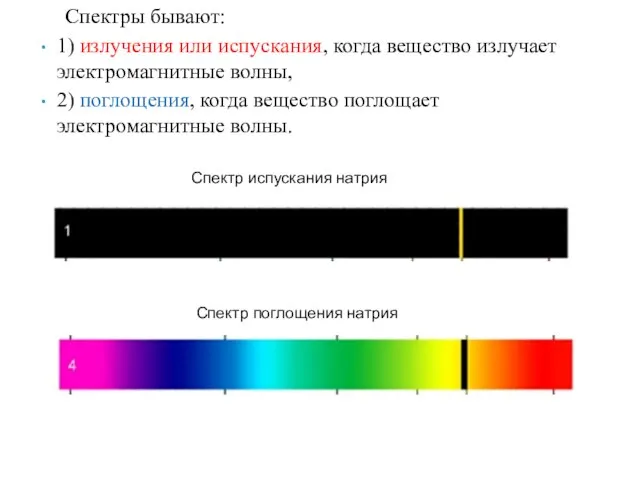
- 15. Спектры бывают: 1) излучения или испускания, когда вещество излучает электромагнитные волны, 2) поглощения, когда вещество поглощает
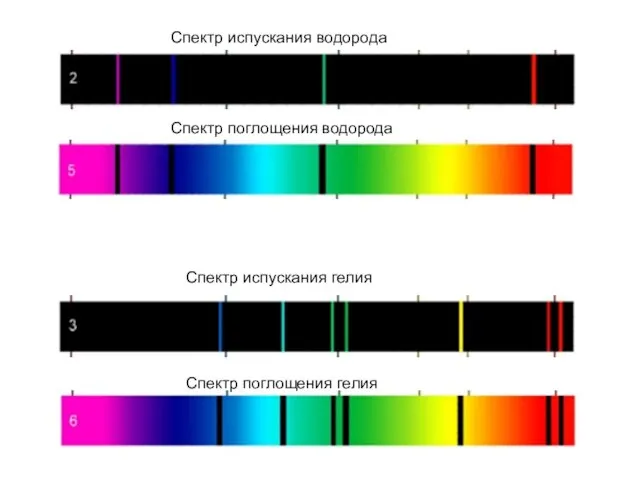
- 16. Спектр испускания водорода Спектр испускания гелия Спектр поглощения водорода Спектр поглощения гелия
- 17. Спектроскоп. Спектроскоп - это прибор для наблюдения спектров. Спектрограф - это прибор для получения фотографий спектров.
- 18. Спектральный анализ. Спектральный анализ -это метод определения химического состава вещества по его спектру. Спектральный анализ основан
- 19. Лаборатория спектрального анализа.
- 20. С помощью спектрального анализа можно обнаружить данный элемент в составе сложного вещества. Благодаря универсальности спектральный анализ
- 21. В настоящее время в криминалистике широко используются телевизионные спектральные системы (ТСС). - обнаружение различного рода подделок
- 22. В 1913 году датский физик Нильс Бор сформулировал основные положения квантовой физики в виде постулатов. В
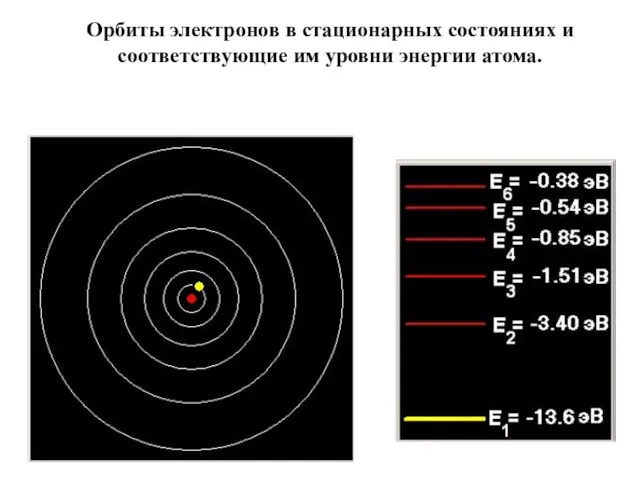
- 23. Постулаты Бора: 1. (постулат стационарных состояний) Атом может находится в особых квантовых или стационарных состояниях, каждому
- 24. Орбиты электронов в стационарных состояниях и соответствующие им уровни энергии атома.
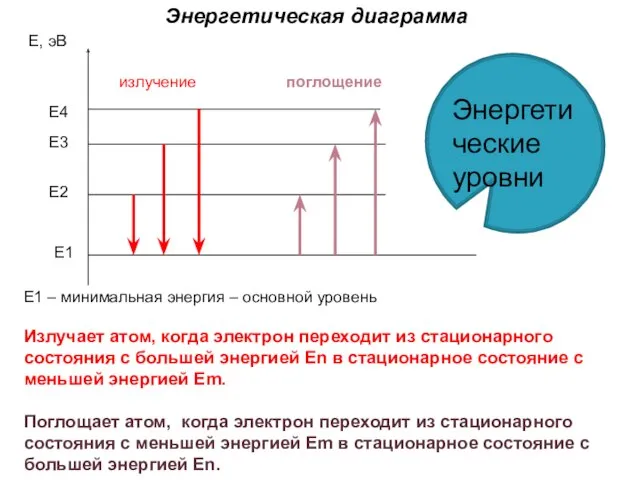
- 25. Е, эВ Е2 Е1 Е3 Е4 излучение поглощение Энергетическая диаграмма Энергетические уровни Е1 – минимальная энергия
- 26. Тест на самопроверку 1. Какие опыты послужили основанием для создания ядерной модели атома? А) опыты по
- 27. 2. Сколько электронов содержится в электронной оболочке нейтрального атома, в атомном ядре которого содержится 7 протонов
- 28. 4. Светящаяся поверхность Солнца-фотосфера создает А) спектр только из желтых и оранжевых линий; В) спектр только
- 29. 5. Частота света, соответствующая фотонам с энергией 50∙10-19 Дж, равна ( h = 6,62∙10-34 Дж∙с) А)
- 31. Скачать презентацию

















 Решение задач по теме Электромагнитная индукция
Решение задач по теме Электромагнитная индукция Условия плавания тел
Условия плавания тел Основы термодинамики. Внутренняя энергия
Основы термодинамики. Внутренняя энергия Презентация на тему Линзы. Типы линз
Презентация на тему Линзы. Типы линз  Теория автоматического управления. Дифференцирующие звенья
Теория автоматического управления. Дифференцирующие звенья Электрическое поле. Действие электрического поля на заряды. 8 класс
Электрическое поле. Действие электрического поля на заряды. 8 класс Полное внутреннее отражение
Полное внутреннее отражение Основы электротехники. Трехфазные цепи
Основы электротехники. Трехфазные цепи Электромагниты
Электромагниты Три состояния вещества
Три состояния вещества ВКБ-приближение. Общие соотношения
ВКБ-приближение. Общие соотношения Механическое движение
Механическое движение Композиты и нанокомпозиты
Композиты и нанокомпозиты Конденсаторы
Конденсаторы Классификация подъемно-транспортных машин
Классификация подъемно-транспортных машин Действие магнитного поля на проводник с током. Сила Ампера. Взаимодействие проводников с током
Действие магнитного поля на проводник с током. Сила Ампера. Взаимодействие проводников с током Протоколы квантового распределения ключей
Протоколы квантового распределения ключей Вибрация подшипников качения
Вибрация подшипников качения Газоразрядные приборы
Газоразрядные приборы Проектирование системы управления с повторяющими шагами
Проектирование системы управления с повторяющими шагами Расчёт массы и объёма тела по его плотности. 7 класс
Расчёт массы и объёма тела по его плотности. 7 класс Магнитное поле
Магнитное поле ВКР: Расчет, изготовление и исследование амплитудной цилиндрической линзы
ВКР: Расчет, изготовление и исследование амплитудной цилиндрической линзы Презентация на тему Принцип Гюйгенса. Закон отражение света
Презентация на тему Принцип Гюйгенса. Закон отражение света  Kental. Profesional presentation template
Kental. Profesional presentation template Презентация на тему История открытия законов сохранения импульса
Презентация на тему История открытия законов сохранения импульса  Основные понятия электротехники. Основные величины электротехники. Закон Ома
Основные понятия электротехники. Основные величины электротехники. Закон Ома Призматический фасонный резец
Призматический фасонный резец