Содержание
- 2. Атомная и ядерная физика раздел физики, изучающий строение атома и атомного ядра и процессы, связанные с
- 3. Явления, подтверждающие сложное строение атома Явление электролиза (Фарадей, 1833г) Электромагнитная теория света (Максвелл) Рентгеновские лучи (1895)
- 4. Демокрит существует предел деления атома Аристотель Делимость вещества бесконечна 1626г, Париж Учение об атоме запрещено по
- 5. Первая модель атома — модель Томсона (1903 г.). Положительно заряженный шар, внутри которого находятся электроны («пудинг
- 6. Недостатки модели атома Томсона Она не могла объяснить излучения большого числа спектральных линий Не давала возможность
- 7. Томсон, пытаясь согласовать эту модель с данными спектроскопии и периодическим законом Менделеева, распределял электроны по концентрическим
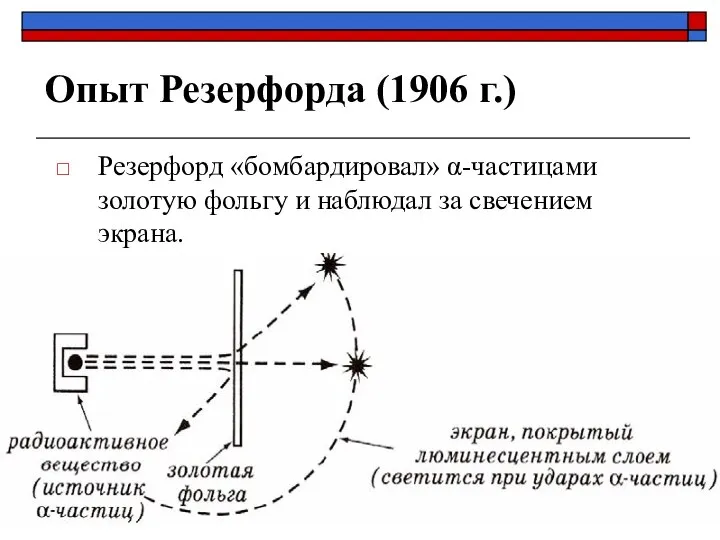
- 8. Опыт Резерфорда (1906 г.) Резерфорд «бомбардировал» α-частицами золотую фольгу и наблюдал за свечением экрана.
- 9. При попадании α-частицы на экран возникает свечение люминесцентного слоя.
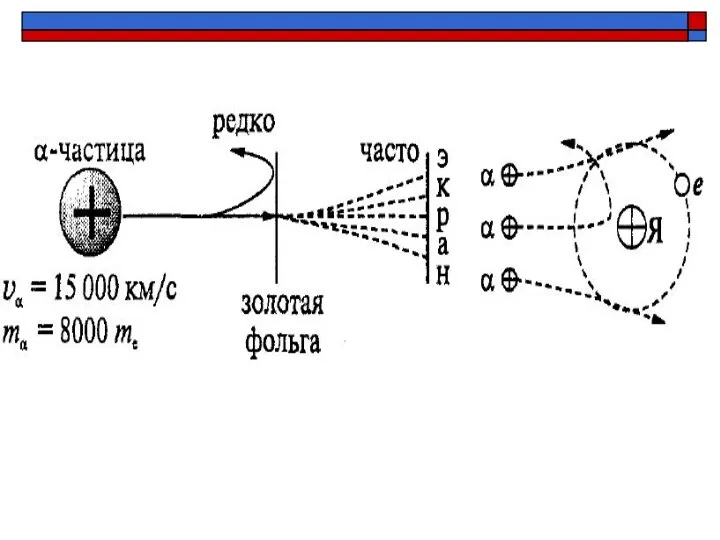
- 10. Наблюдения из опыта большинство α -частиц пролетает сквозь фольгу не отклоняясь небольшое количество α -частиц отклоняется
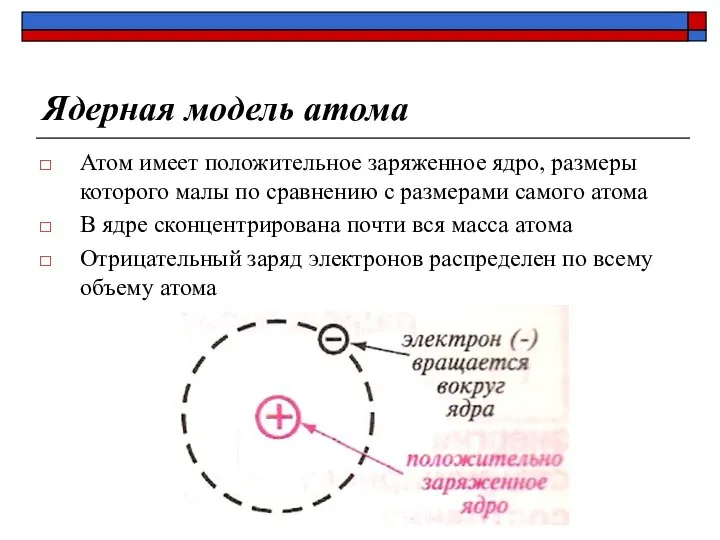
- 12. Ядерная модель атома Атом имеет положительное заряженное ядро, размеры которого малы по сравнению с размерами самого
- 13. Выводы Резерфорда (модель атома):
- 14. Отличие атомных систем от планетных Планеты притягиваются к Солнцу силами всемирного тяготения. Электроны притягиваются к ядру
- 15. Противоречия планетарной модели атома и классической физики Но: атом устойчив!!! 1)
- 16. 2) Вследствие непрерывной потери Е электрона, атом должен излучать непрерывный спектр, но атом излучает линейчатый спектр.
- 17. Вывод Эти противоречия объясняются невозможностью применения к электронам в атомах законов классической физики.
- 18. Это интересно Если бы все электроны тела человека прижились к ядрам так ,чтобы внутри атомной пустоты
- 20. Скачать презентацию














 Движение. Тело отсчёта
Движение. Тело отсчёта Проектирование участка механической обработки детали Вал тихоходный на базе предприятия ПАО Кузнецов
Проектирование участка механической обработки детали Вал тихоходный на базе предприятия ПАО Кузнецов Физические величины. Измерение физических величин. Точность и погрешность измерений
Физические величины. Измерение физических величин. Точность и погрешность измерений Вращение шестеренки
Вращение шестеренки Электролиз. Удивительный мир гальваники
Электролиз. Удивительный мир гальваники Электрические машины. Законы электромеханики
Электрические машины. Законы электромеханики Электромагнитные волны
Электромагнитные волны Рамка с током в магнитном поле
Рамка с током в магнитном поле Классическое определение вероятности Решение задач.
Классическое определение вероятности Решение задач. Законы движения планет. Неинерциальные системы координат
Законы движения планет. Неинерциальные системы координат Технологии обработки металлов, выполняемые в ССХТ
Технологии обработки металлов, выполняемые в ССХТ Материалы, применяемые в электронике, электротехнике и радиотехнике
Материалы, применяемые в электронике, электротехнике и радиотехнике Однотактные преобразователи с потенциальной развязкой
Однотактные преобразователи с потенциальной развязкой Лазеры
Лазеры Испарение и конденсация
Испарение и конденсация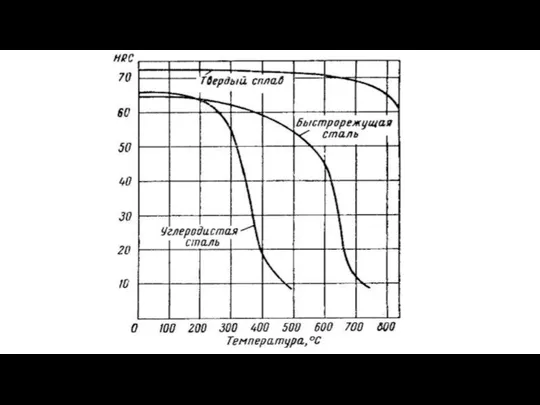 Номинальные допустимые напряжения для труб из углеродистых сталей при разных температурах, МПа
Номинальные допустимые напряжения для труб из углеродистых сталей при разных температурах, МПа Кинематика
Кинематика Переменный ток. Тема №4
Переменный ток. Тема №4 Виды излучении
Виды излучении Электромагнитные колебания
Электромагнитные колебания Работа, мощность. Энергия
Работа, мощность. Энергия Презентация на тему Изменение агрегатного состояния вещества
Презентация на тему Изменение агрегатного состояния вещества  Физика: явления, приборы, величины. Природа и техника
Физика: явления, приборы, величины. Природа и техника ВПР. ЭЗ и Веер 1 и 2. Лекция 2
ВПР. ЭЗ и Веер 1 и 2. Лекция 2 Явление тяготения. Сила тяжести
Явление тяготения. Сила тяжести Спектрометрия ультрафиолетовой и видимой части спектра
Спектрометрия ультрафиолетовой и видимой части спектра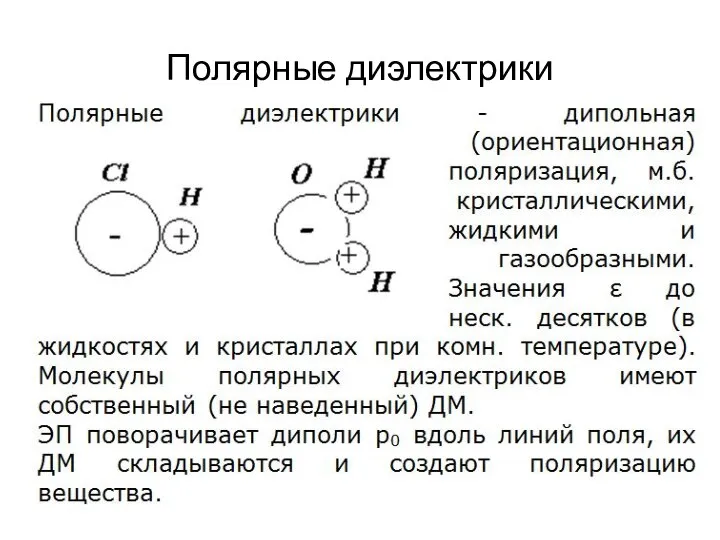 Полярные диэлектрики
Полярные диэлектрики Влияние электромагнитного излучения на организм и здоровье человека
Влияние электромагнитного излучения на организм и здоровье человека