Содержание
- 2. Основные понятия молекулярно-кинетической теории – Относительная молекулярная масса; – количество вещества; – постоянная Авогадро; – молярная
- 3. Так как массы молекул очень малы, удобно использовать в расчётах не абсолютные значения масс, а относительные.
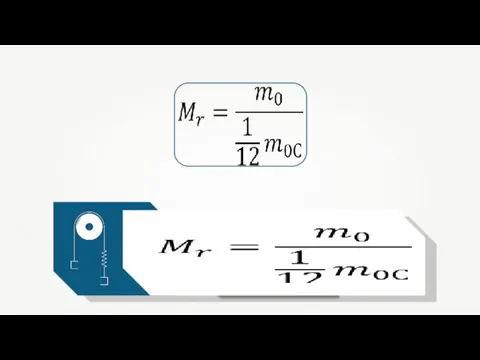
- 4. Основные понятия молекулярно-кинетической теории Массу частицы, измеренную в а.е.м. (атомная единица массы), принято называть относительной атомной
- 5. Основные понятия молекулярно-кинетической теории Относительная молекулярная масса молекулы вещества равна сумме относительных атомных масс атомов, составляющих
- 7. Основные понятия молекулярно-кинетической теории CO2 Mr(CO2) ≈ 44 12 + 2 · 16 = 44
- 9. 1 моль равен количеству вещества, в котором содержится столько же атомов или молекул, сколько атомов содержится
- 10. Амедео Авогадро 1776–1856 гг. Число Авогадро — число молекул в одном моле любого вещества или число
- 11. Масса одного атома углерода: m0C = 1,995 · 10-23 кг. Число Авогадро
- 12. Количество вещества равно отношению числа частиц в теле к числу Авогадро (числу молекул в 1 моле
- 13. Если два разных тела состоят из одного и того же числа частиц, то эти тела содержат
- 14. Молярная масса (M) равна массе вещества, взятого в количестве 1 моль.
- 15. Периодическая система химических элементов Дмитрия Ивановича Менделеева
- 16. Молярная масса
- 17. Молярная масса
- 18. Молярная масса Для молекул более сложного состава при расчёте учитывается число атомов всех химических элементов в
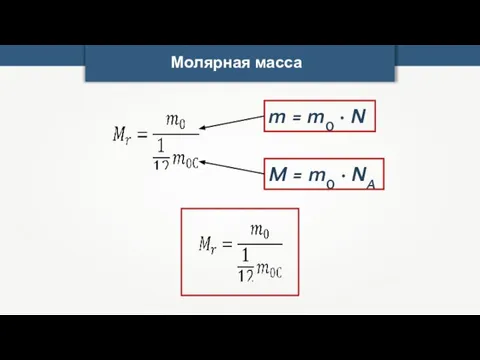
- 19. Молярная масса m0 — масса одной молекулы вещества. M = m0 · NA m — масса
- 20. Молярная масса M = m0 · NA m = m0 · N
- 21. Масса молекулы (m0) может быть рассчитана на основе молярной массы (M) и числа Авогадро (NA). Масса
- 22. Масса молекулы Молекула водорода (H2) m0(H) = 1,67 · 10-27 кг H Атом водорода (H) m0(H2)
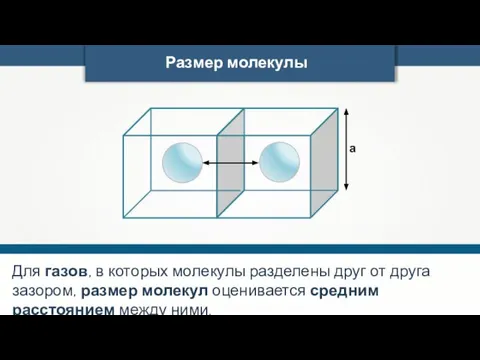
- 23. Размер молекулы а Для воды диаметр а = 3 · 10–10 м.
- 24. Размер молекулы а Для газов, в которых молекулы разделены друг от друга зазором, размер молекул оценивается
- 25. Концентрация (?) показывает, сколько частиц содержится в единице объёма данного вещества.
- 26. Определите молярную массу воды (H2O). Дано: Найти: M(H2O) = ? Решение: Mr(H2O) = 2 · 1
- 28. Скачать презентацию





















 Гидростатический парадокс
Гидростатический парадокс Изобретение радио. Принципы радиосвязи
Изобретение радио. Принципы радиосвязи Молекулярно-кинетическая теория
Молекулярно-кинетическая теория Презентация на тему Инфракрасное и ультрафиолетовое излучения
Презентация на тему Инфракрасное и ультрафиолетовое излучения  Получение электричества с помощью волос
Получение электричества с помощью волос Водяные бомбочки
Водяные бомбочки Импульс тела . Закон сохранения импульса
Импульс тела . Закон сохранения импульса Высокотемпературные сверхпроводники
Высокотемпературные сверхпроводники Прямолинейное равноускоренное движение. Ускорение
Прямолинейное равноускоренное движение. Ускорение Тест по теме Радио
Тест по теме Радио Турнир юных знатоков физики
Турнир юных знатоков физики Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел. (8 класс)
Агрегатные состояния вещества. Плавление и отвердевание кристаллических тел. (8 класс) Нелинейно-оптические методы измерений в фемтосекундной оптике
Нелинейно-оптические методы измерений в фемтосекундной оптике Термодинамика. Подготовка к контрольной работе
Термодинамика. Подготовка к контрольной работе Агрегатные состояния вещества
Агрегатные состояния вещества Управление потоком поверхностных плазмонполяритонов с помощью внешних полей
Управление потоком поверхностных плазмонполяритонов с помощью внешних полей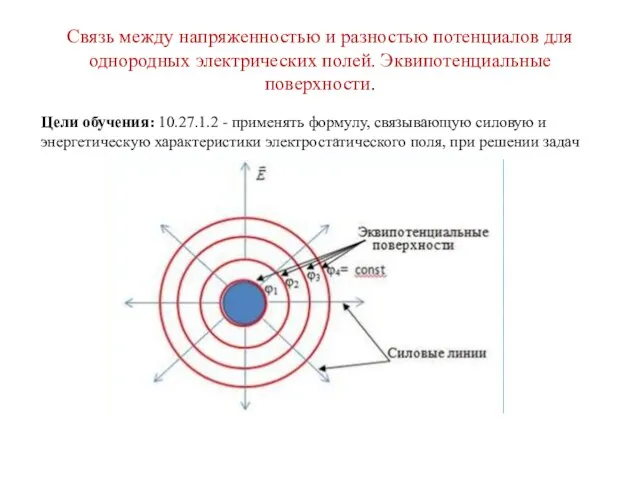 Связь между напряженностью и разностью потенциалов для однородных электрических полей. Эквипотенциальные поверхности
Связь между напряженностью и разностью потенциалов для однородных электрических полей. Эквипотенциальные поверхности Құрылтак шарттары
Құрылтак шарттары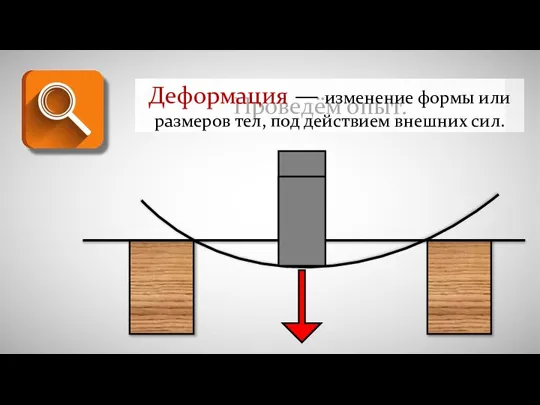 Деформация - изменение формы или размеров тел под действием внешних сил
Деформация - изменение формы или размеров тел под действием внешних сил Швейная машина. История и устройсво
Швейная машина. История и устройсво Место доказательств в научном познании
Место доказательств в научном познании Динамика вязкой жидкости
Динамика вязкой жидкости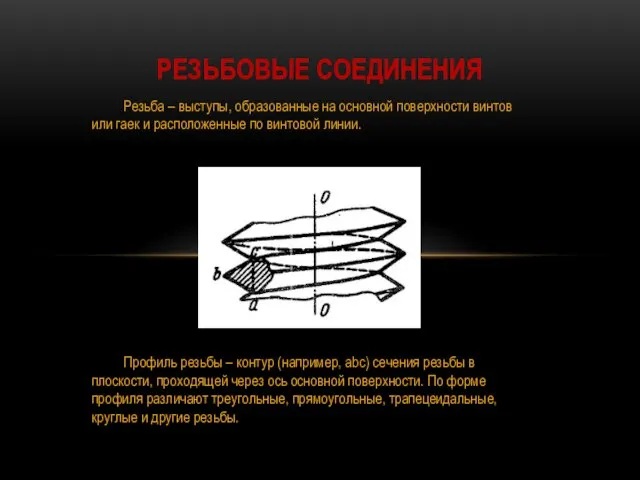 Порядок решения задач на резьбовые соединения
Порядок решения задач на резьбовые соединения Переменный электрический ток. Вынужденные электромагнитные колебания
Переменный электрический ток. Вынужденные электромагнитные колебания Молекулярная физика и термодинамика. Тест
Молекулярная физика и термодинамика. Тест ВКР: Методика определения глубины максимума ШАЛ по длительности импульса Черенковского излучения
ВКР: Методика определения глубины максимума ШАЛ по длительности импульса Черенковского излучения Закон Ома. Сопротивление проводника. Решение задач
Закон Ома. Сопротивление проводника. Решение задач Закон Архимеда
Закон Архимеда