Содержание
- 2. ДЖОЗЕФ ДЖОН ТОМСОН(1856-1940) В конце 19-го века открыл электрон. Масса электрона оказалась примерно в две тысячи
- 3. МОДЕЛЬ АТОМА ТОМСОНА Внутри положительно заряженного шара диаметром около 10 м находятся отрицательно заряженные электроны. -10
- 4. ЭРНЕСТ РЕЗЕРФОРД(1871-1937) В начале 20-го века английский физик Эрнест Резерфорд открыл атомное ядро. Оказалось, что в
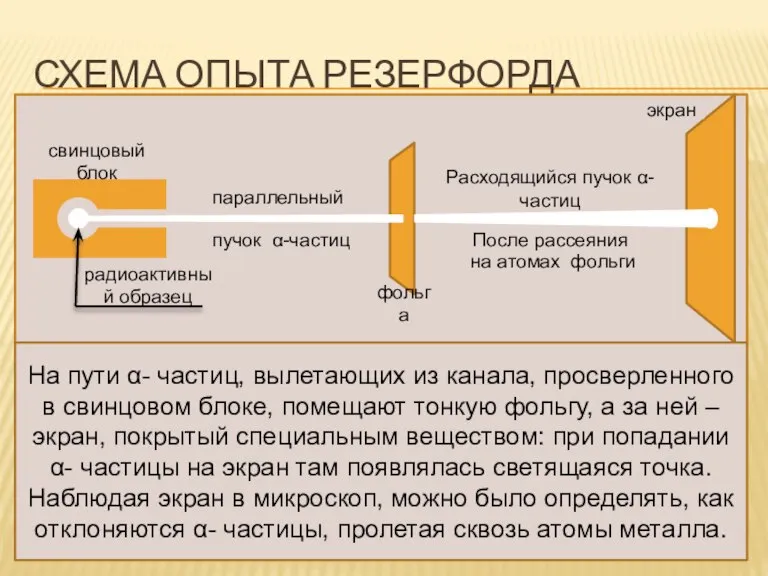
- 5. СХЕМА ОПЫТА РЕЗЕРФОРДА Расходящийся пучок α-частиц экран После рассеяния на атомах фольги фольга параллельный пучок α-частиц
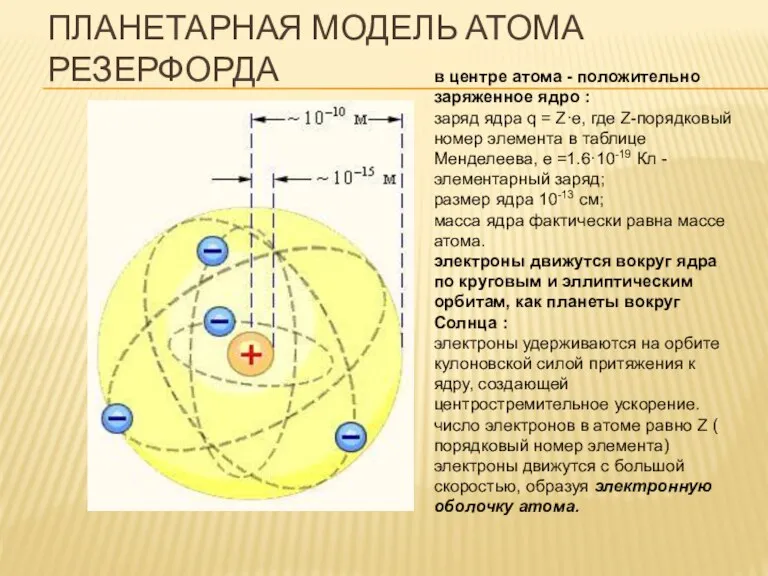
- 6. ПЛАНЕТАРНАЯ МОДЕЛЬ АТОМА РЕЗЕРФОРДА в центре атома - положительно заряженное ядро : заряд ядра q =
- 7. НИЛЬС ХЕНРИК ДАВИД БОР(1885-1962) В 1913 году, предпринял первую попытку “угадать” новые законы атомной физики. В
- 8. КВАНТОВЫЕ ПОСТУЛАТЫ БОРА Первый постулат: Атомы имеют ряд стационарных состояний соответствующих определенным значениям энергий: Е1, Е2...En.
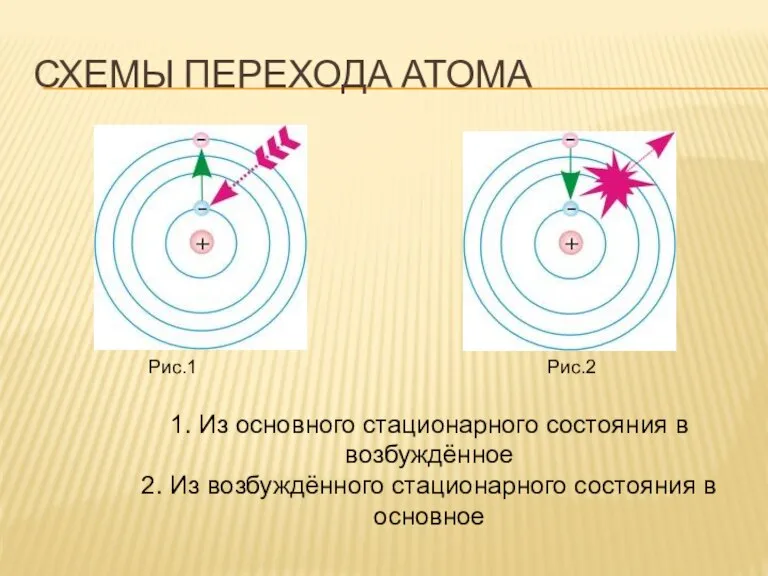
- 9. СХЕМЫ ПЕРЕХОДА АТОМА Рис.1 Рис.2 1. Из основного стационарного состояния в возбуждённое 2. Из возбуждённого стационарного
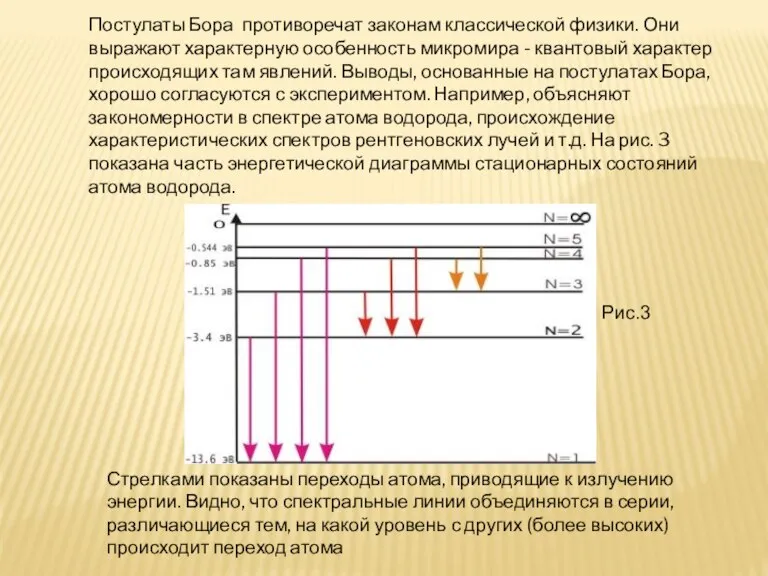
- 10. Постулаты Бора противоречат законам классической физики. Они выражают характерную особенность микромира - квантовый характер происходящих там
- 12. Скачать презентацию





 Визначення питомого опору провідника
Визначення питомого опору провідника Применение переменного тока. (Лекция 9)
Применение переменного тока. (Лекция 9) Поглощенная доза излучения. Основы дозиметрии
Поглощенная доза излучения. Основы дозиметрии Тепловые явления
Тепловые явления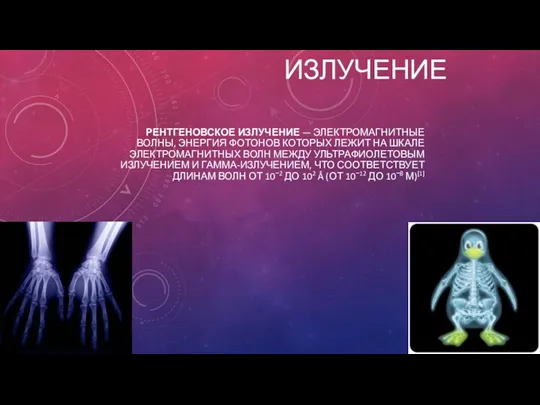 Рентгеновское излучение
Рентгеновское излучение Возможна ли машина времени
Возможна ли машина времени Презентация на тему Короткое замыкание
Презентация на тему Короткое замыкание  Презентация на тему Основы термодинамики Решение задач
Презентация на тему Основы термодинамики Решение задач  Закон Ома для участка цепи
Закон Ома для участка цепи Электризация тел. Два рода электрического заряда
Электризация тел. Два рода электрического заряда Новые цели школьного физического образования – новые учебные задачи
Новые цели школьного физического образования – новые учебные задачи Динамика. Законы Ньютона
Динамика. Законы Ньютона ППШ
ППШ Расчет сложных цепей постоянного тока
Расчет сложных цепей постоянного тока Решение задач с использованием понятия массовая доля
Решение задач с использованием понятия массовая доля Физики, внесшие вклад в развитие науки и техники в годы Великой Отечественной войны
Физики, внесшие вклад в развитие науки и техники в годы Великой Отечественной войны Решение качественных и вычислительных задач: практическая работа. 10 класс
Решение качественных и вычислительных задач: практическая работа. 10 класс Динамика. Подготовка к ЕГЭ
Динамика. Подготовка к ЕГЭ Часы и общество
Часы и общество Детали машин. Механические передачи машин. Параметры передач
Детали машин. Механические передачи машин. Параметры передач Принципиальные электро-схема (6 класс)
Принципиальные электро-схема (6 класс) Краткая характеристика физико-химических методов анализа
Краткая характеристика физико-химических методов анализа Презентация на тему Электрическая цепь
Презентация на тему Электрическая цепь  Динамика материальной точки
Динамика материальной точки силы
силы Интегрированный урок по теме: Копченые продукты со вкусом физики и запахом истории
Интегрированный урок по теме: Копченые продукты со вкусом физики и запахом истории Типология современного урока (ФГОС)
Типология современного урока (ФГОС) Колебательный контур. Превращение энергии при электромагнитных колебаниях
Колебательный контур. Превращение энергии при электромагнитных колебаниях