Содержание
- 2. Термодина́мика — раздел физики, изучающий наиболее общие свойства макроскопических систем и способы передачи и превращения энергии
- 4. ОСНОВЫ ТЕРМОДИНАМИКИ Это теория о наиболее общих свойствах макроскопических тел. Макроскопической системой называется всякий материальный объект,
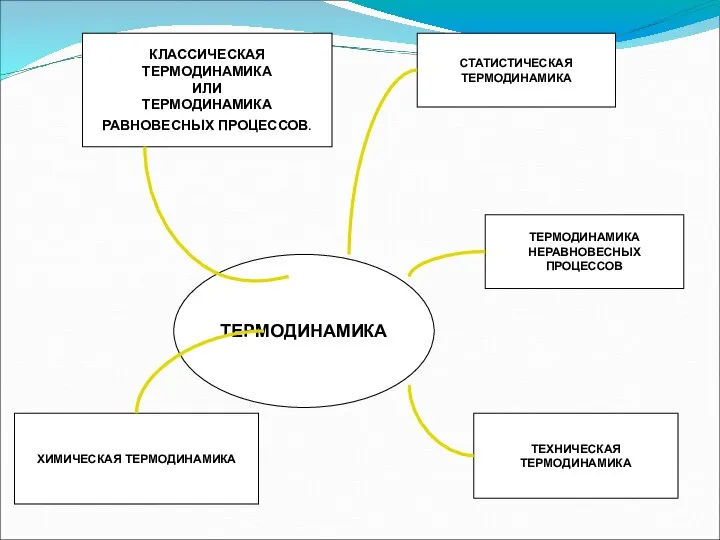
- 5. ЧТО ИЗУЧАЕТ ТЕРМОДИНАМИКА? √ Возникла как наука тепловых процессов, рассматриваемых с точки зрения энергетических преобразований. √
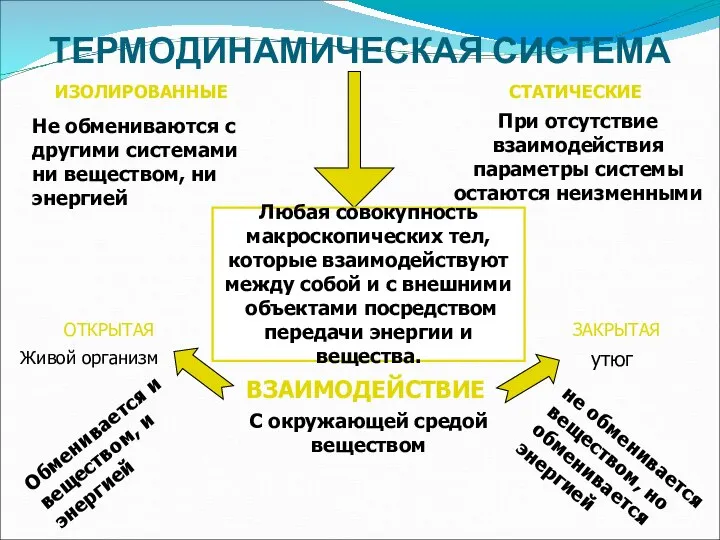
- 6. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА Любая совокупность макроскопических тел, которые взаимодействуют между собой и с внешними объектами посредством передачи
- 7. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА Гомогенная Гетерогенная - однородная система, химический состав и физические свойства которой во всех частях
- 8. Неравновесное состояние Всякое бесконечно малое воздействие вызывает конечное изменение состояния системы Равновесное состояние – состояние, при
- 9. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ Совокупность физических величин, характеризующих свойства термодинамической системы.
- 10. Неравновесное состояние
- 11. Теплоемкость Для изобарного процесса: Для изохорного процесса: Уравнения Кирхгофа Степенной ряд
- 12. I ЗАКОН ТЕРМОДИНАМИКИ Изменение внутренней энергии ΔU системы равно сумме работы A совершенной внешними телами над
- 13. ТЕРМОДИНАМИКА ИЗОПРОЦЕССОВ Процессы, происходящие при постоянном значении одного из параметров состояния (T,V или P) с данной
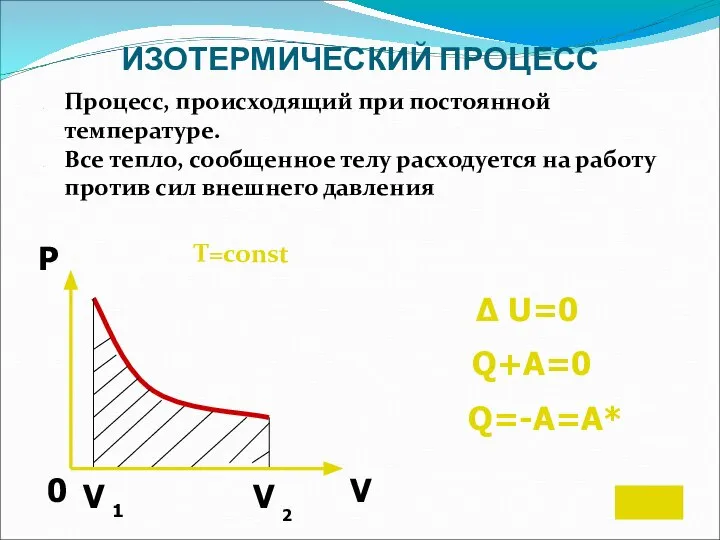
- 14. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС Процесс, происходящий при постоянной температуре. Все тепло, сообщенное телу расходуется на работу против сил
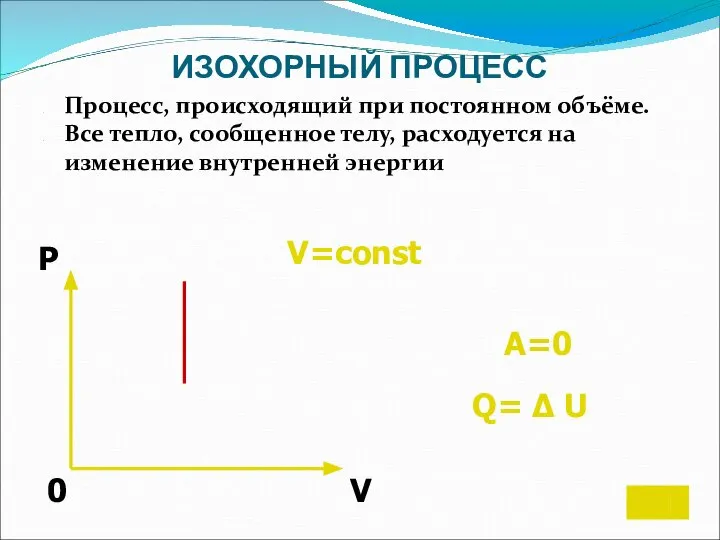
- 15. ИЗОХОРНЫЙ ПРОЦЕСС Процесс, происходящий при постоянном объёме. Все тепло, сообщенное телу, расходуется на изменение внутренней энергии
- 16. ИЗОБАРНЫЙ ПРОЦЕСС Процесс, происходящий при постоянном давлении. A*=p ( + ) ΔU=A+Q Q=A*+ Δ U
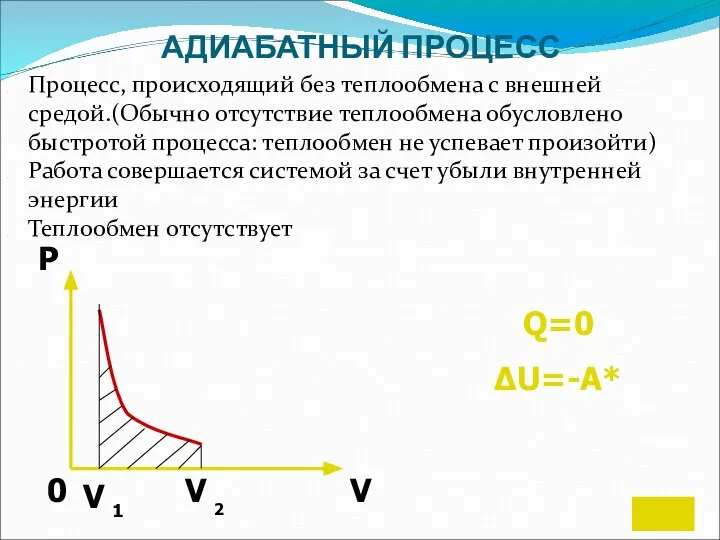
- 17. АДИАБАТНЫЙ ПРОЦЕСС Процесс, происходящий без теплообмена с внешней средой.(Обычно отсутствие теплообмена обусловлено быстротой процесса: теплообмен не
- 18. Закон Гесса Тепловой эффект химической реакции при постоянном давлении, объеме зависит только от вида и состояния
- 19. Следствия из закона Гесса: Для реакции: aA + bB = cC + dD
- 20. II ЗАКОН ТЕРМОДИНАМИКИ Тепловые процессы необратимы. Не возможно перевести теплоту от более холодной системы к более
- 21. КПД тепловой машины
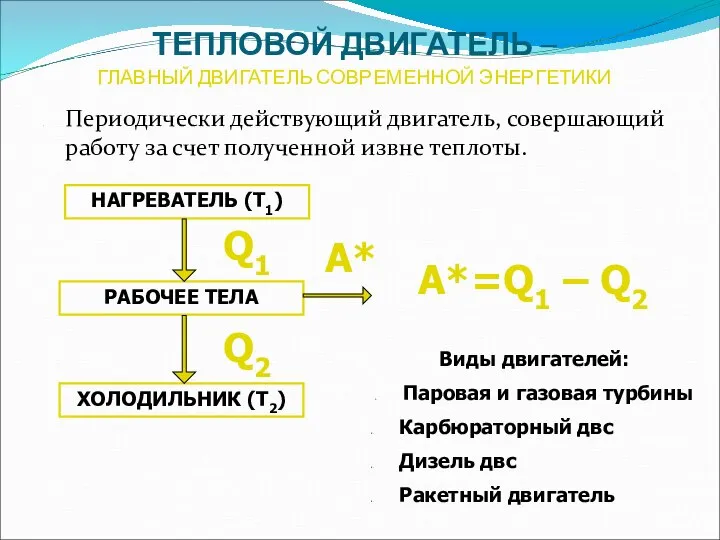
- 22. ТЕПЛОВОЙ ДВИГАТЕЛЬ – ГЛАВНЫЙ ДВИГАТЕЛЬ СОВРЕМЕННОЙ ЭНЕРГЕТИКИ Периодически действующий двигатель, совершающий работу за счет полученной извне
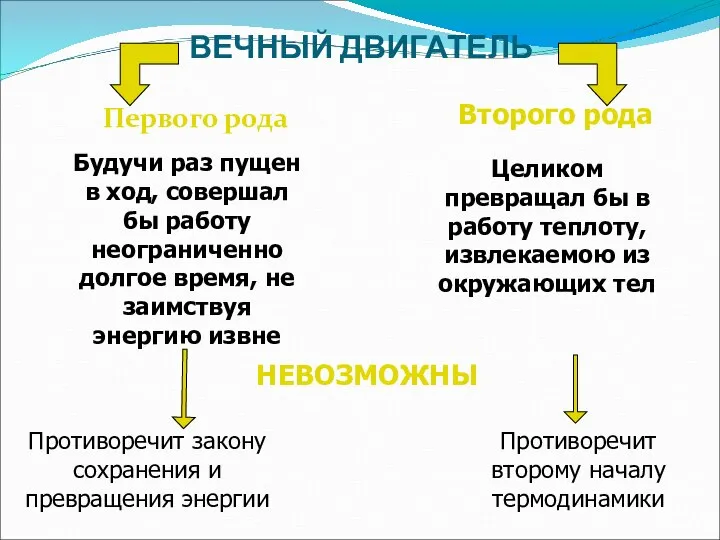
- 23. ВЕЧНЫЙ ДВИГАТЕЛЬ Первого рода Второго рода Целиком превращал бы в работу теплоту, извлекаемою из окружающих тел
- 24. Энтропия В окружающей нас природе термодинамически обратимых процессов нет.
- 25. Расчетные формулы для определения энтропии В окружающей нас природе термодинамически обратимых процессов нет.
- 26. Термодинамические потенциалы Существуют две функции для определения возможности протекания процессов в закрытых системах 1. Изохорно-изотермический потенциал
- 28. Скачать презентацию


















 Механическое движение
Механическое движение Использование элементов развивающего обучения на уроках физики по сингапурской системе обучения
Использование элементов развивающего обучения на уроках физики по сингапурской системе обучения Поперечная дифференциальная токовая защита. Выключатели с одной стороны линий
Поперечная дифференциальная токовая защита. Выключатели с одной стороны линий Расчет стабилизированного источника питания
Расчет стабилизированного источника питания Активация в ядерной физике. (Тема 2.8)
Активация в ядерной физике. (Тема 2.8) Земной магнетизм
Земной магнетизм Гравитационное поле Земли. Часть 2
Гравитационное поле Земли. Часть 2 Постулаты Бора. Модель атома водорода по Бору
Постулаты Бора. Модель атома водорода по Бору Коническая передача
Коническая передача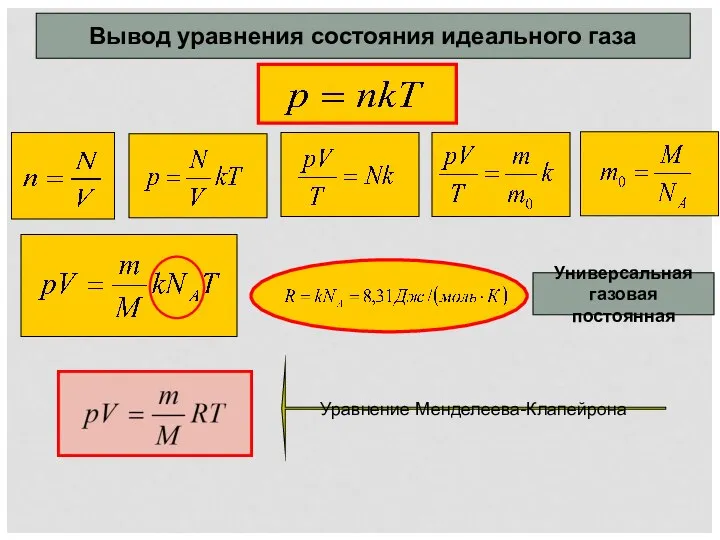 Вывод уравнения Менделеева-Клайперона. Изопроцессы
Вывод уравнения Менделеева-Клайперона. Изопроцессы Равновесие жидкости и газа
Равновесие жидкости и газа Электричество. 8 класс
Электричество. 8 класс Конденсатор. Энергия заряженного конденсатора
Конденсатор. Энергия заряженного конденсатора Устойчивость режима работы реактора. Лекция № 5
Устойчивость режима работы реактора. Лекция № 5 Демонстрация свойств электромагнитных волн с использованием источника СВЧ излучения
Демонстрация свойств электромагнитных волн с использованием источника СВЧ излучения Аккумулирование энергии
Аккумулирование энергии Мембранные процессы
Мембранные процессы Презентация по физике "Решение задач на расчет работы и мощности" -
Презентация по физике "Решение задач на расчет работы и мощности" -  Рабочие режимы электроэнергетических систем. Методы и средства регулирования рабочих режимов
Рабочие режимы электроэнергетических систем. Методы и средства регулирования рабочих режимов Магнетизм. Переменный ток. (Лекция 5)
Магнетизм. Переменный ток. (Лекция 5) Термодинамика. Тест
Термодинамика. Тест Прикладная физика. Введение в дисциплину
Прикладная физика. Введение в дисциплину Импульс тела
Импульс тела Динамика фотоионизации атомов благородных газов между первым и вторым порогом ионизации
Динамика фотоионизации атомов благородных газов между первым и вторым порогом ионизации Масса тела
Масса тела Физические величины, используемые в химии
Физические величины, используемые в химии Электромагнитные волны
Электромагнитные волны Лекция 23. Оптика. Волновая оптика
Лекция 23. Оптика. Волновая оптика