Содержание
- 2. Величины, характеризующие состояние макроскопических тел без учета их молекулярного строения (V, p, t), называют макроскопическими параметрами.
- 3. Распространённые в быту термометры – ртутные, спиртовые и т.д. – не отвечают физическим стандартам измерения температур.
- 4. По шкале Цельсия, при градуировке термометра берется за 0 температура тающего льда, а за 100 -
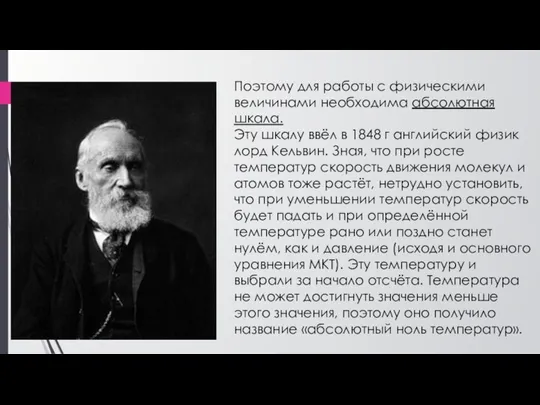
- 5. Поэтому для работы с физическими величинами необходима абсолютная шкала. Эту шкалу ввёл в 1848 г английский
- 6. Обозначение температуры: Т Единица измерения: К, «кельвин» Перевод к шкале Кельвина: 1К= 1⸰С+273 Абсолютный ноль температур
- 7. Температура является мерой средней кинетической энергией поступательного движения.
- 12. Количественные зависимости между двумя параметрами газа называю газовыми законами. Процессы, протекающие при неизменном значении одного из
- 13. Изотермический процесс – процесс перехода идеального газа из одного состояния в другое без изменения температуры. Закон,
- 14. При увеличении объёма наблюдается уменьшение давления, и наоборот. График зависимости давления газа от объёма при постоянной
- 16. При увеличении температуры наблюдается увеличение объёма, и наоборот. График зависимости меняющихся величин в уравнении, то есть
- 18. При увеличении температуры наблюдается увеличение давления, и наоборот. График зависимости меняющихся величин в уравнении, то есть
- 20. Скачать презентацию
















 Индивидуальное задание для практики (2)
Индивидуальное задание для практики (2) Презентация на тему Магнитные явления
Презентация на тему Магнитные явления  Историческая справка. Звук в воздухе
Историческая справка. Звук в воздухе Давление твердых тел, жидкостей и газов
Давление твердых тел, жидкостей и газов Особенности конструкций V-образных двигателей
Особенности конструкций V-образных двигателей Обзор способов получения диоксида титана
Обзор способов получения диоксида титана Испарение и конденсация
Испарение и конденсация Основы аэродинамики
Основы аэродинамики Звук и характеристика
Звук и характеристика Абсолютный нуль температуры
Абсолютный нуль температуры Механизм газораспределения
Механизм газораспределения Диагностика электронных систем управления бензиновых двигателей
Диагностика электронных систем управления бензиновых двигателей Общие теоремы динамики
Общие теоремы динамики Лазеры. Виды лазеров
Лазеры. Виды лазеров Индукция магнитного поля
Индукция магнитного поля Переменное прямолинейное движение
Переменное прямолинейное движение Методы регистрации заряженных частиц
Методы регистрации заряженных частиц Поперечный изгиб
Поперечный изгиб Задания ЕГЭ по физике
Задания ЕГЭ по физике Сказка про радио
Сказка про радио Аэродинамика. Лекция 2
Аэродинамика. Лекция 2 Модель и свойства твердых тел
Модель и свойства твердых тел Электроэпиляция. Открытие электролиза
Электроэпиляция. Открытие электролиза Принципы радиосвязи и телевидения
Принципы радиосвязи и телевидения Презентация на тему Приливы, отливы, их использование
Презентация на тему Приливы, отливы, их использование  T-S диаграмма
T-S диаграмма Явление люминесценции
Явление люминесценции Трехфазные цепи
Трехфазные цепи