Содержание
- 2. Термодинамика Термодинамика – теория тепловых процессов, в которой не учитывается молекулярное строение тел. В её основе
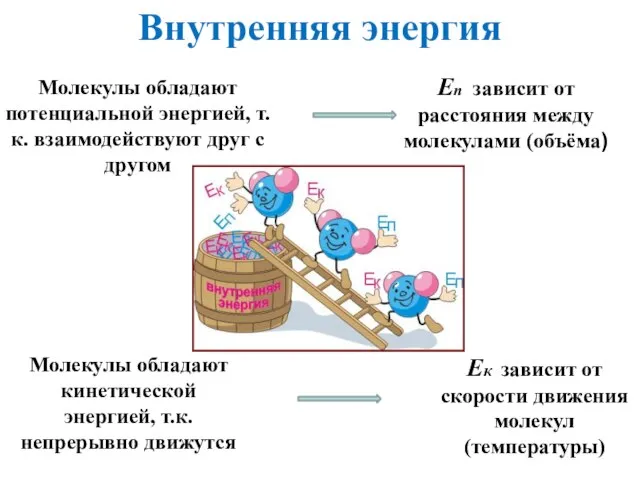
- 3. Внутренняя энергия Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех частиц тела (молекул,
- 4. Ек зависит от скорости движения молекул (температуры) Молекулы обладают кинетической энергией, т.к. непрерывно движутся Еп зависит
- 5. Внутренняя энергия идеального одноатомного газа Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной температуры Молекулы
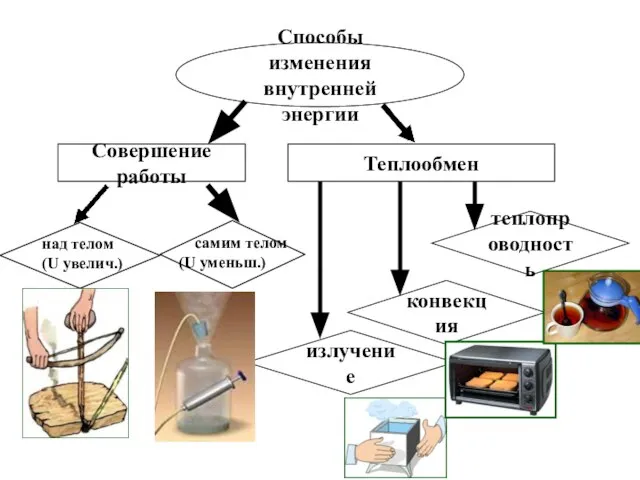
- 6. Способы изменения внутренней энергии Совершение работы Теплообмен теплопроводность конвекция излучение над телом (U увелич.) самим телом
- 7. Работа в термодинамике По третьему закону Ньютона: Работа внешних сил над газом: Работа газа: Вычислим работу
- 8. Количество теплоты Процесс передачи энергии от одного тела к другому без совершения работы называют теплообменом(или теплопередачей).
- 9. Закон сохранения энергии Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно,
- 10. Первый закон термодинамики Изменение внутренней энергии системы при переходе её из одного состояние в другое равно
- 11. Вечный двигатель - воображаемое устройство, способное бесконечно совершать работу без затрат топлива или других энергетических ресурсов.
- 12. Невозможность создания вечного двигателя Из первого закона термодинамики вытекает невозможность создания вечного двигателя. Если к системе
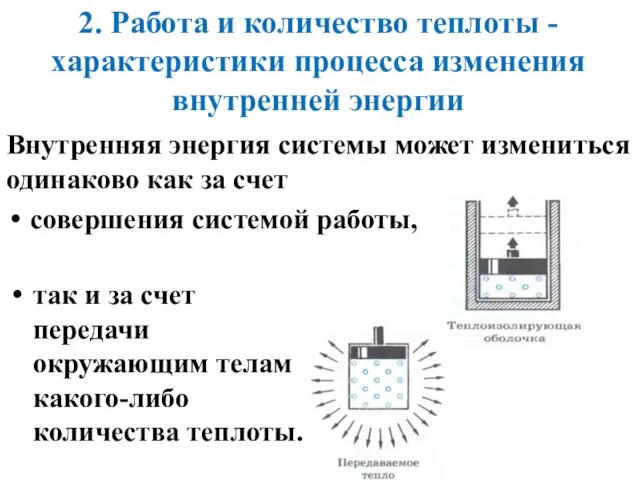
- 13. 2. Работа и количество теплоты - характеристики процесса изменения внутренней энергии Внутренняя энергия системы может измениться
- 14. Изотермический процесс При изотермическом процессе T=const и внутренняя энергия идеального газа не меняется: , а следовательно
- 15. Изобарный процесс При изобарном процессе передаваемое газу количество теплоты идет и на изменение его внутренней энергии
- 16. Изохорный процесс При изохорном процессе объем газа не меняется V=const, и поэтому работа газа равна нулю
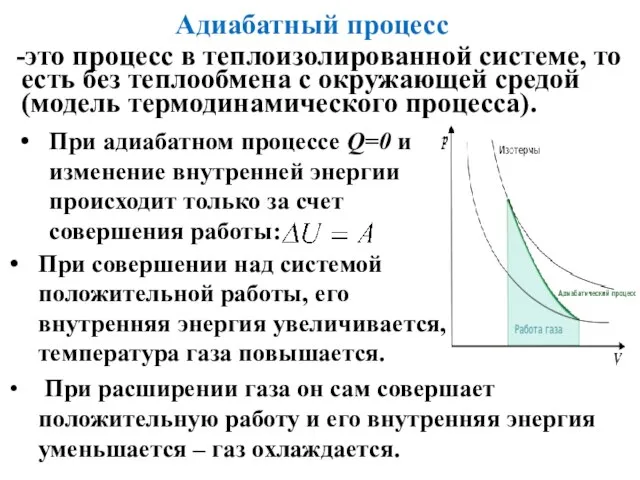
- 17. Адиабатный процесс -это процесс в теплоизолированной системе, то есть без теплообмена с окружающей средой (модель термодинамического
- 18. 4.Теплообмен в изолированной системе получим уравнение теплового баланса:
- 19. Необратимость процессов Многие процессы, вполне допустимые с точки зрения закона сохранения энергии, никогда не протекают в
- 21. Скачать презентацию













 Применение правила равновесия рычага к блоку. Золотое правило механики
Применение правила равновесия рычага к блоку. Золотое правило механики Презентация на тему Амперметр
Презентация на тему Амперметр  Типовой расчет №3. Молекулярная физика и термодинамика
Типовой расчет №3. Молекулярная физика и термодинамика Физика конденсированного состояния
Физика конденсированного состояния Волшебница вода
Волшебница вода Электростатика
Электростатика Давление. Фонтан Герона
Давление. Фонтан Герона Проводники в электростатическом поле
Проводники в электростатическом поле Техническое обслуживание и текущий ремонт тормозной системы Toyota Mark II
Техническое обслуживание и текущий ремонт тормозной системы Toyota Mark II Модели строения атома
Модели строения атома Колебания математического и пружинного маятников
Колебания математического и пружинного маятников з-н сохр.имп
з-н сохр.имп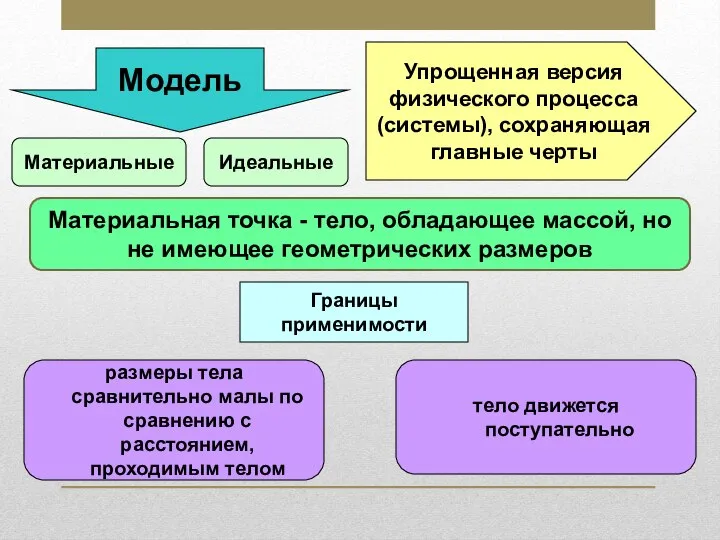 Материальная точка
Материальная точка Электричество и магнетизм. Электрическое поле в диэлектриках (Лекция 5)
Электричество и магнетизм. Электрическое поле в диэлектриках (Лекция 5) Физический океан
Физический океан T-S диаграмма
T-S диаграмма Найважливіші відкриття Ніколи Тесли
Найважливіші відкриття Ніколи Тесли Драйвер двигателя постоянного тока. Вспомогательные функции
Драйвер двигателя постоянного тока. Вспомогательные функции Волновые передачи
Волновые передачи Колесный бульдозер
Колесный бульдозер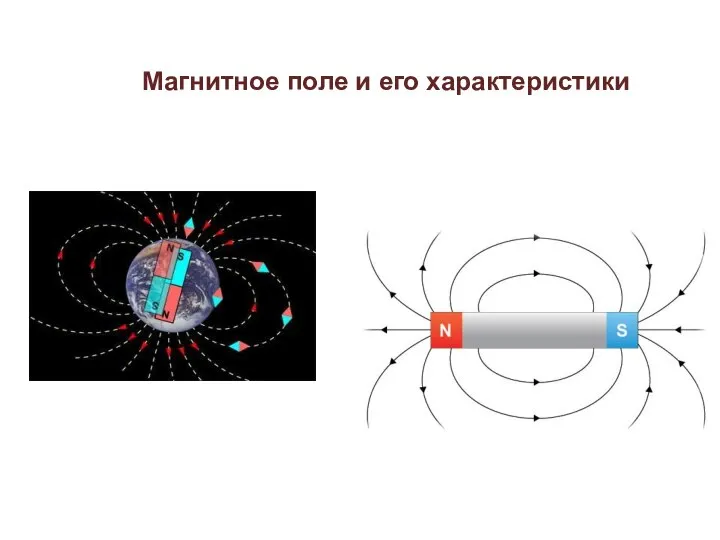 магнитное поле (1)
магнитное поле (1)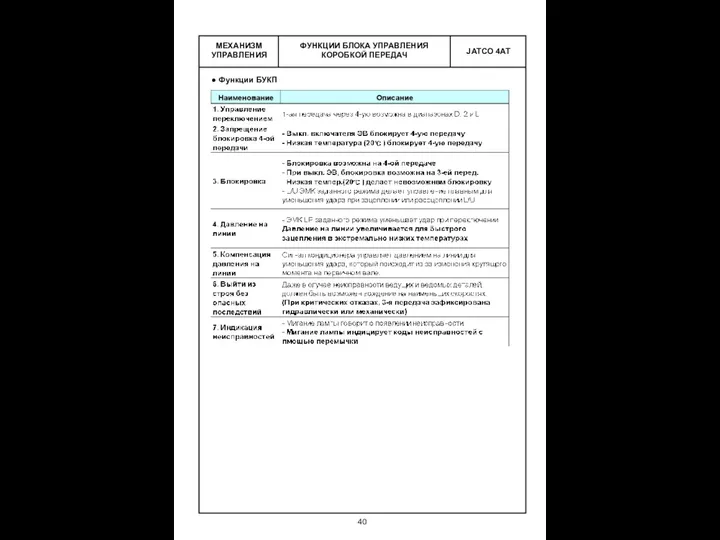 Механизм управления. Функции блока управления коробкой передач
Механизм управления. Функции блока управления коробкой передач Проверочные вопросы по теме Этапы работы над исследовательским проектом
Проверочные вопросы по теме Этапы работы над исследовательским проектом Большой адронный коллайдер
Большой адронный коллайдер Проектная работа по физике на тему Преобразование электрической энергии в механическую. Сила Ампера
Проектная работа по физике на тему Преобразование электрической энергии в механическую. Сила Ампера Основные требования, предъявляемые к устройствам релейной защиты
Основные требования, предъявляемые к устройствам релейной защиты Переходные процессы в ЭЦ
Переходные процессы в ЭЦ 680-сильная Toyota Camry
680-сильная Toyota Camry