Презентация к уроку: Гибридизация Атома Углерода ФИО автора: Сафарова Марина Александровна Должность: учитель химии МОУ Лицея №1
Содержание
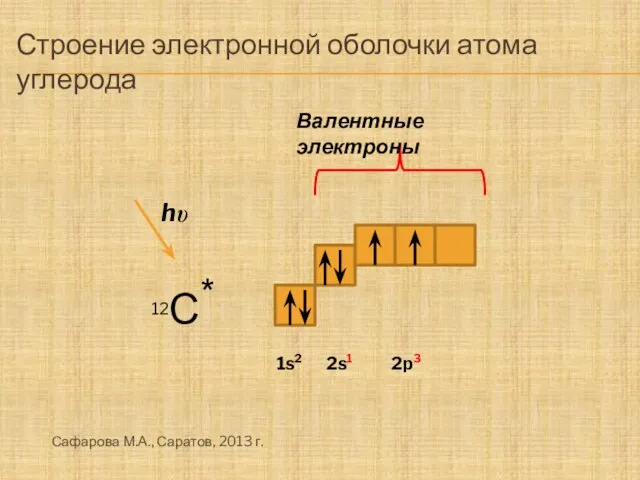
- 2. Строение электронной оболочки атома углерода 12С * hu Валентные электроны 1s2 2s2 2p2 2s1 2p3 Сафарова
- 3. Гибридизация атома углерода В зависимости от количества орбиталей, принимающих участие в гибридизации, различают sp3-, sp2- и
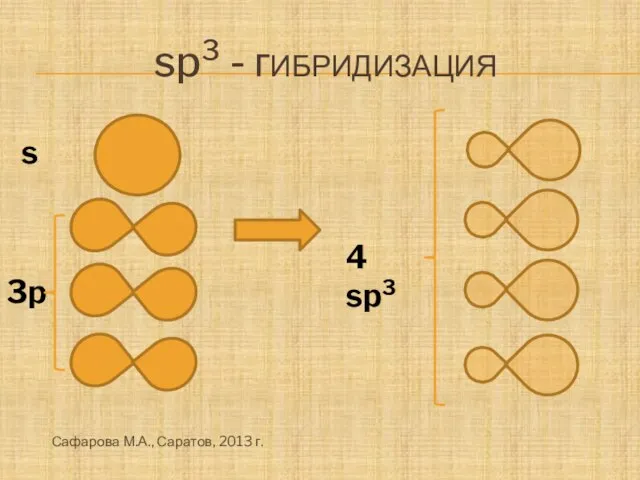
- 4. sp3 - гибридизация 3p s 4 sp3 Сафарова М.А., Саратов, 2013 г.
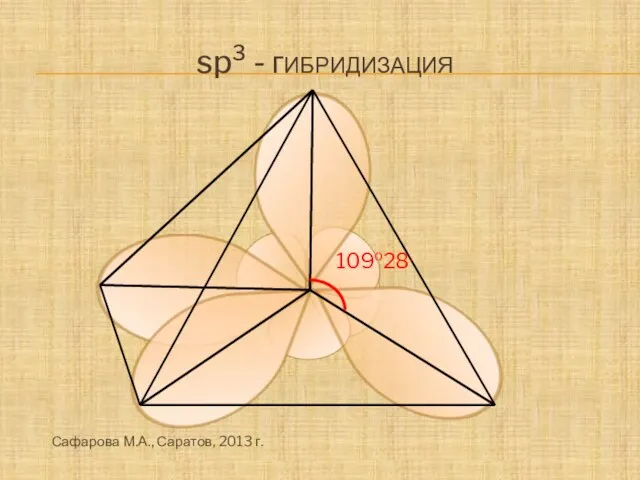
- 5. 109o28, sp3 - гибридизация Сафарова М.А., Саратов, 2013 г.
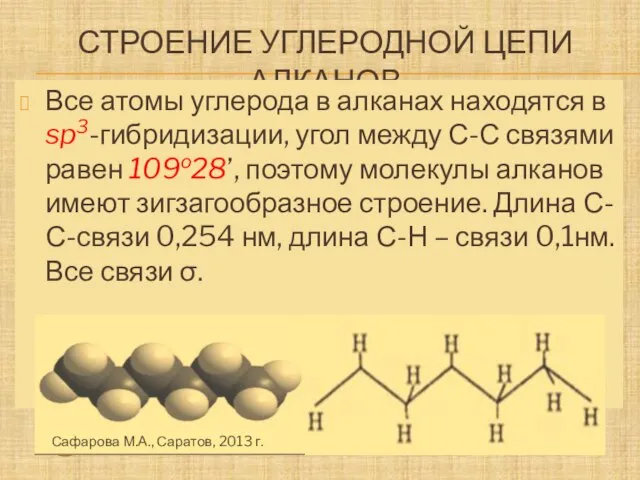
- 6. Строение углеродной цепи алканов Молекула метана Молекула этана - Атомы водорода Все атомы углерода в алканах
- 7. В алмазе атомы углерода находятся в sp3 – гибридизации. Сафарова М.А., Саратов, 2013 г.
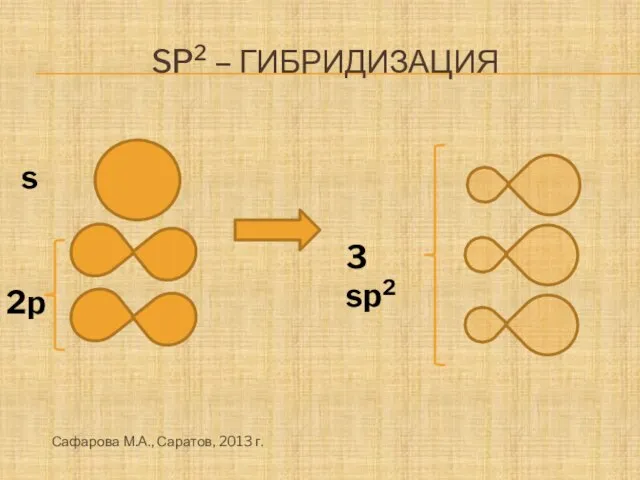
- 8. Sp2 – гибридизация s 3 sp2 2p Сафарова М.А., Саратов, 2013 г.
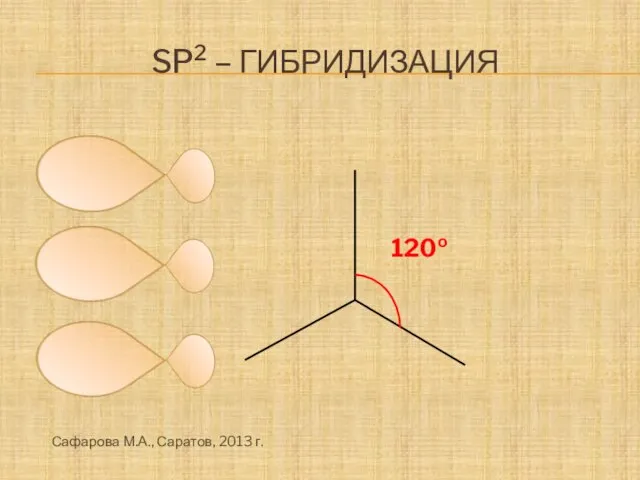
- 9. Sp2 – гибридизация 120о Сафарова М.А., Саратов, 2013 г.
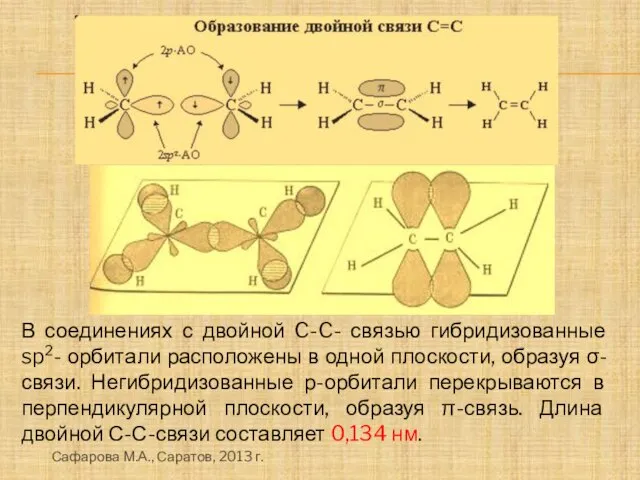
- 10. В соединениях с двойной C-C- связью гибридизованные sp2- орбитали расположены в одной плоскости, образуя σ-связи. Негибридизованные
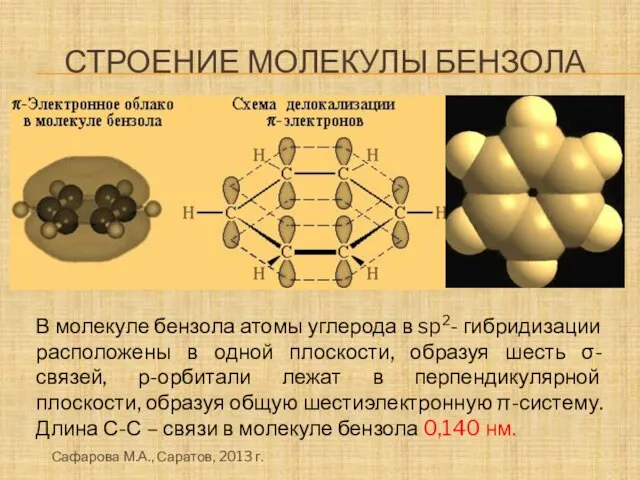
- 11. Строение молекулы бензола В молекуле бензола атомы углерода в sp2- гибридизации расположены в одной плоскости, образуя
- 12. В молекуле графита атомы углерода находятся в sp2- гибридизации. Бензольное кольцо можно рассматривать как структурную единицу
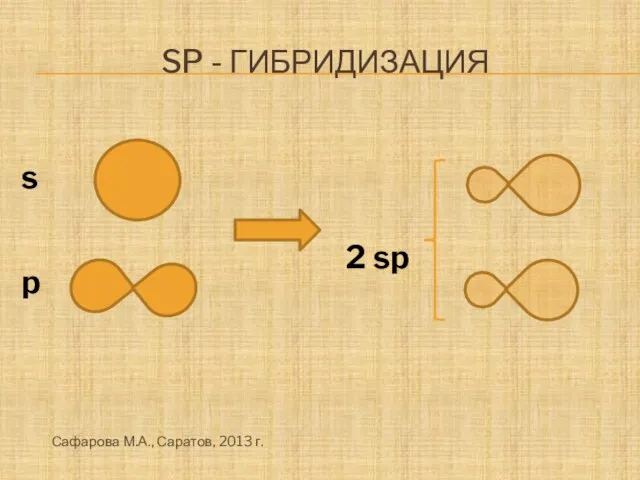
- 13. Sp - гибридизация s 2 sp p Сафарова М.А., Саратов, 2013 г.
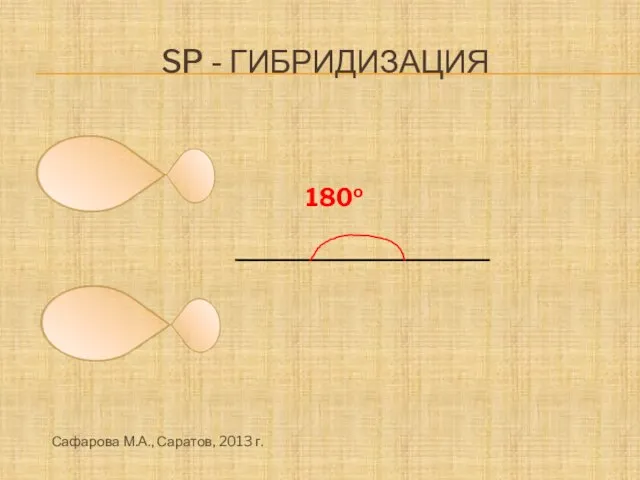
- 14. Sp - гибридизация 180о Сафарова М.А., Саратов, 2013 г.
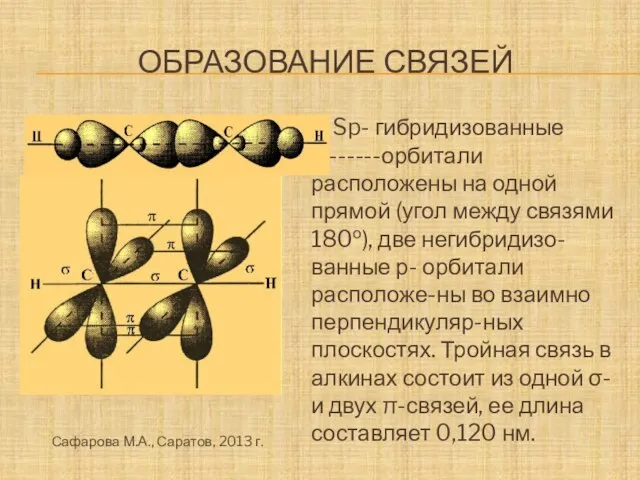
- 15. образование связей Sp- гибридизованные --------орбитали расположены на одной прямой (угол между связями 180о), две негибридизо-ванные р-
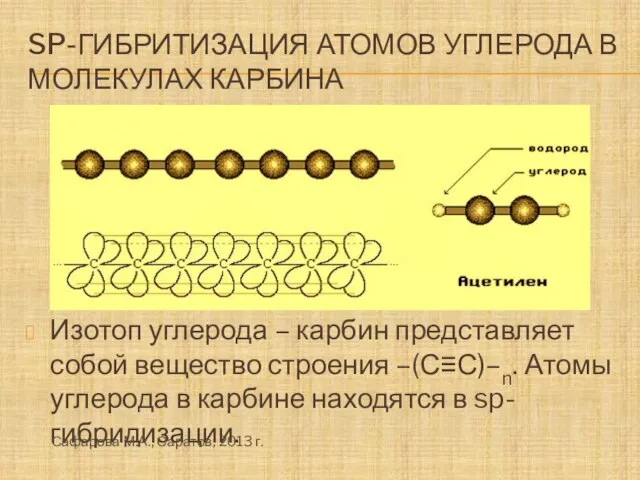
- 16. Sp-гибритизация атомов углерода в молекулах карбина Изотоп углерода – карбин представляет собой вещество строения –(С≡С)–n. Атомы
- 18. Скачать презентацию



 Resistenza dei materiali
Resistenza dei materiali Изучение механизмов и их работа Тема: Повторение тем
Изучение механизмов и их работа Тема: Повторение тем Основы динамического электричества
Основы динамического электричества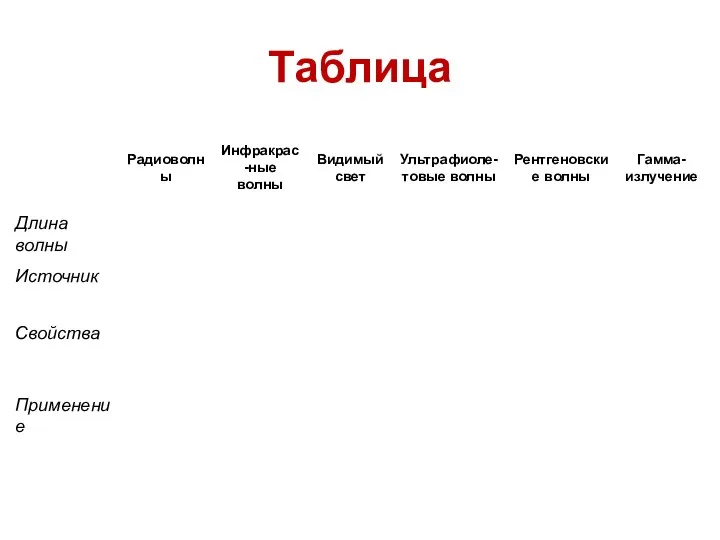 Радиоволны. Таблица. 9 класс
Радиоволны. Таблица. 9 класс Магнитное поле и его характеристики
Магнитное поле и его характеристики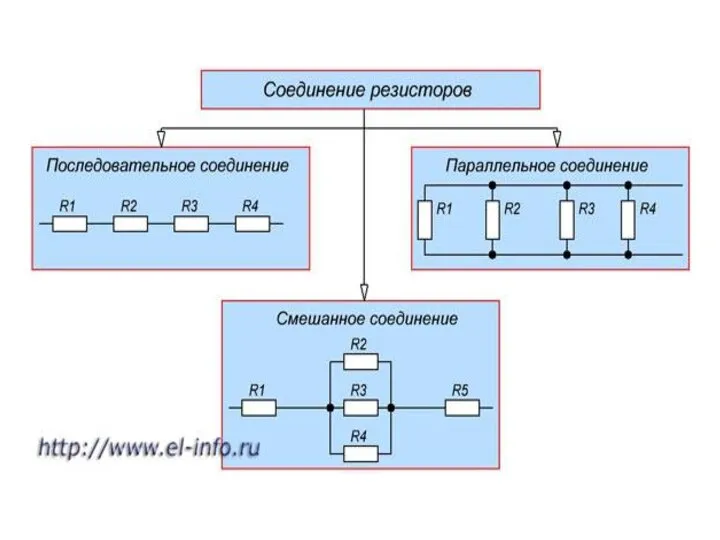 Соединения резисторов
Соединения резисторов Электрический ток. 8 класс
Электрический ток. 8 класс Оптика и квантовая физика. Лекция 12
Оптика и квантовая физика. Лекция 12 Сила трения
Сила трения Передачи механические
Передачи механические Механическое движение. Движется или не движется?
Механическое движение. Движется или не движется? Строение атома
Строение атома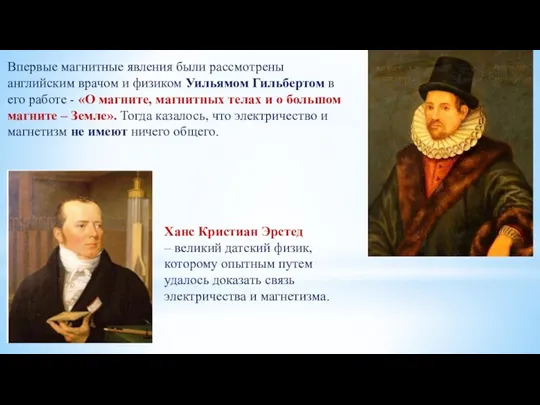 магнитное поле. Урок 8
магнитное поле. Урок 8 Статика. Силы. Момент силы
Статика. Силы. Момент силы Фотоны. Эффект Комптона
Фотоны. Эффект Комптона Современные теплообменные системы
Современные теплообменные системы Движение искусственных спутников
Движение искусственных спутников Тела вращения
Тела вращения Классификация нагрузок
Классификация нагрузок Роль трансформаторов в электропередаче
Роль трансформаторов в электропередаче Дифракция медленных электронов
Дифракция медленных электронов Стоячие волны Урок физики в 10 классе (естественно-научный профиль) © Автор Богданова Ирина Викторовна
Стоячие волны Урок физики в 10 классе (естественно-научный профиль) © Автор Богданова Ирина Викторовна Видатні вчені фізики
Видатні вчені фізики Виды энергии
Виды энергии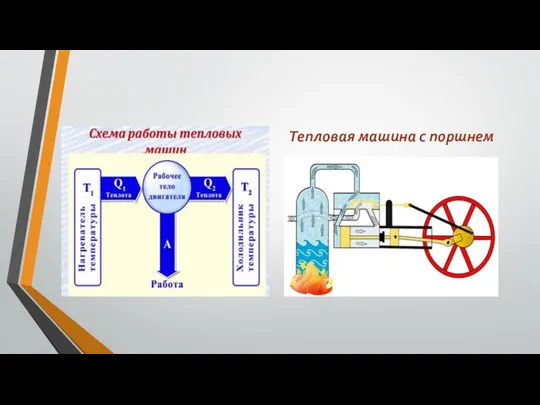 Тепловая машина с поршнем
Тепловая машина с поршнем Биномиальная формула Ньютона
Биномиальная формула Ньютона Действия электрического тока
Действия электрического тока Лабораторные работы по физике (10 класс)
Лабораторные работы по физике (10 класс)