Содержание
- 2. План урока 1. Из истории физики 2. Модель Томсона 3. Опыт Резерфорда 4. Противоречия 5.Постулаты Бора
- 3. Конец XIX века. Из истории физики… 1869г. Д.Менделеев открыл периодический закон 1896 г. А.Беккерель открыл явление
- 4. Модель атома Томсона -е +е -е
- 5. Эрнест Резерфорд (1871-1937) – великий английский физик Науки делятся на две группы - на физику и
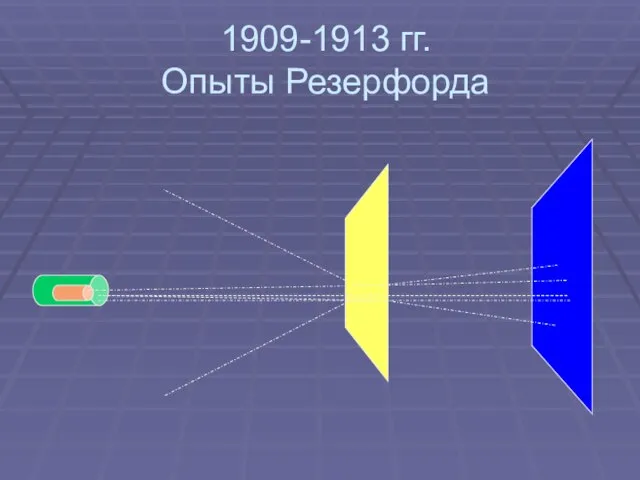
- 6. 1909-1913 гг. Опыты Резерфорда Цель: 1. Исследование распределения положительного заряда 2. Исследование распределения массы внутри атома
- 7. 1909-1913 гг. Опыты Резерфорда
- 8. 1909-1913 гг. Опыты Резерфорда Результаты: 1. Большинство частиц проходит через фольгу не отклоняясь 2. Небольшое число
- 9. 1909-1913 гг. Опыты Резерфорда. Выводы: 1. Положительный заряд атома и его масса сконцентрированы в очень малой
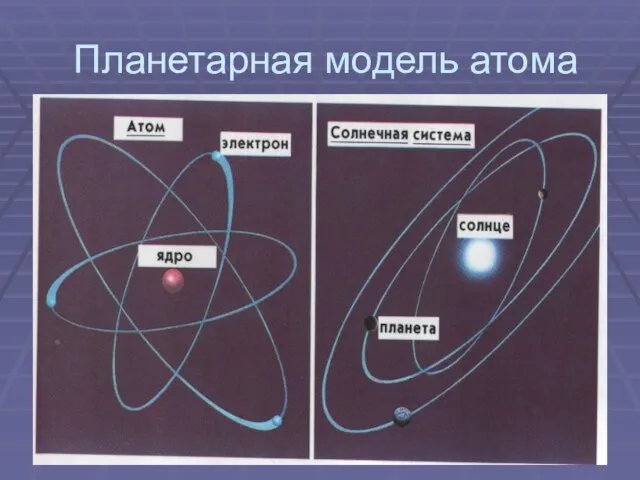
- 10. Планетарная модель атома
- 11. Противоречие между экспериментальными данными и теорией Ускоренное движение электрона по орбите должно сопровождаться постоянным излучением Излучение
- 12. Нильс Бор (1885-1962) великий датский физик Есть два вида истины - тривиальная, которую отрицать нелепо, и
- 13. 1913 г. Нильс Бор Разрешая противоречия, учёл: 1. Линейчатый спектр атомов 2. Модель атома Резерфорда 3.
- 14. Постулаты Бора 1. Атомная система может находиться только в особых стационарных, или квантовых состояниях, каждому из
- 15. Постулаты Бора 2. Излучение света происходит при переходе атома из стационарного состояния с большей энергией Еk
- 16. Постулаты Бора 3. Возможен дискретный ряд орбит по которым электрон может двигаться в стационарном состоянии: m
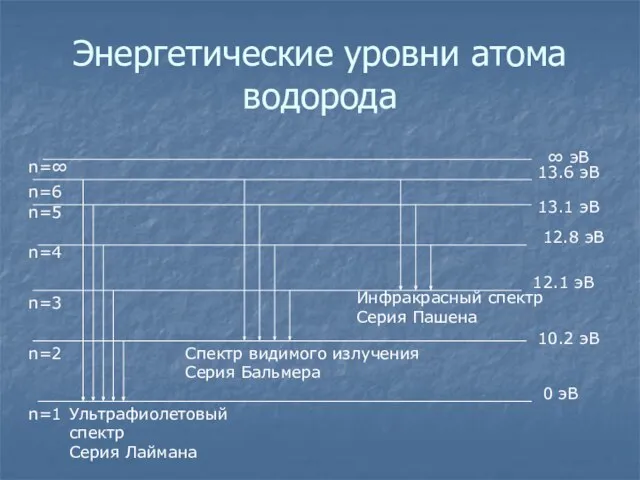
- 17. Энергетические уровни атома водорода 0 эВ 10.2 эВ 12.1 эВ 12.8 эВ 13.1 эВ 13.6 эВ
- 19. Скачать презентацию













 Механическое движение
Механическое движение Естествознание как источник развития техники
Естествознание как источник развития техники Механическое движение
Механическое движение Ионизирующее излучение
Ионизирующее излучение Сила — векторная величина
Сила — векторная величина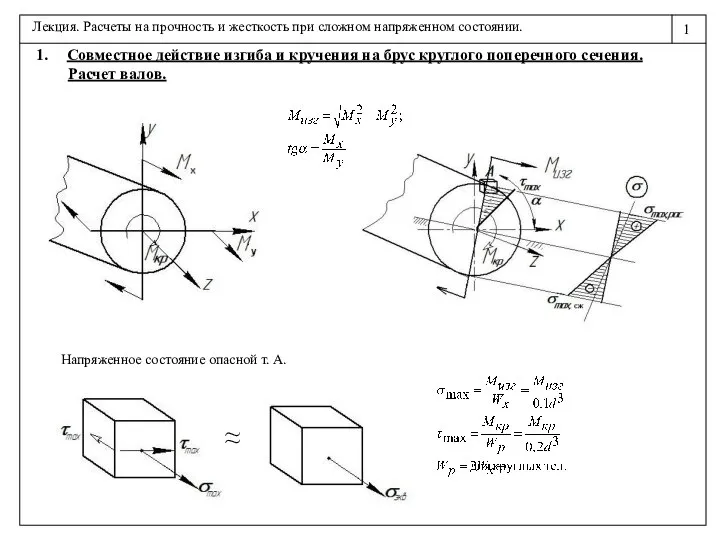 Расчеты на прочность и жесткость при сложном напряженном состоянии
Расчеты на прочность и жесткость при сложном напряженном состоянии Давление твёрдых тел, жидкостей и газов
Давление твёрдых тел, жидкостей и газов Уравновешивание восьмицилиндровых двигателей
Уравновешивание восьмицилиндровых двигателей Нарезание и отделка зубчатых колес
Нарезание и отделка зубчатых колес Решение задач по теме Равновесие твердых тел
Решение задач по теме Равновесие твердых тел Окружающие нас тела называются физическими телами. Строение вещества. Молекула
Окружающие нас тела называются физическими телами. Строение вещества. Молекула Электрические нагрузки. Методы определения расчетных нагрузок. Тема 2.2
Электрические нагрузки. Методы определения расчетных нагрузок. Тема 2.2 История изобретения генератора
История изобретения генератора Физика. Волны. Лекция 10
Физика. Волны. Лекция 10 Сила трения
Сила трения Закон Ома. Розв’язування задач
Закон Ома. Розв’язування задач Презентация на тему Двигатель внутреннего сгорания: принципы
Презентация на тему Двигатель внутреннего сгорания: принципы  Механизмы с параллельной структурой в режиме виброзащиты приборов космических аппаратов
Механизмы с параллельной структурой в режиме виброзащиты приборов космических аппаратов Globale Erwärmung
Globale Erwärmung Работа силы упругости
Работа силы упругости Размерность
Размерность Законы отражения и преломления света
Законы отражения и преломления света Тест. Физика элементарных частиц
Тест. Физика элементарных частиц Замена тросика на энкодере ШП
Замена тросика на энкодере ШП Peremeschenie_put
Peremeschenie_put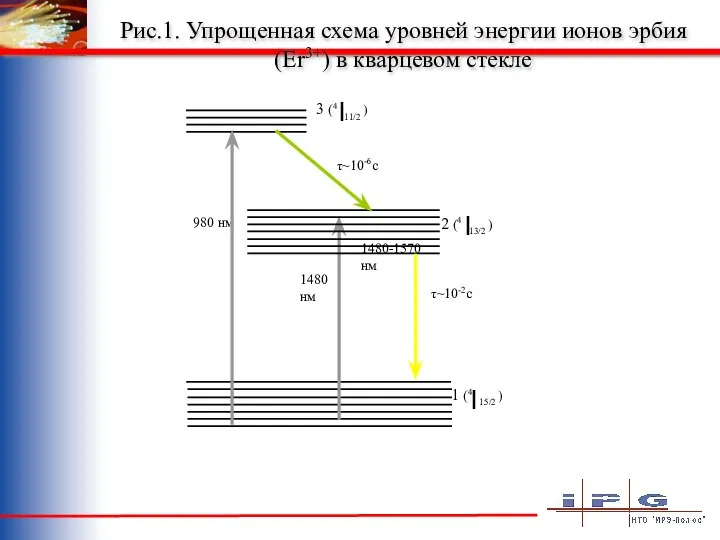 Упрощенная схема уровней энергии ионов эрбия
Упрощенная схема уровней энергии ионов эрбия Простые механизмы. Рычаг
Простые механизмы. Рычаг Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате
Распределение Бозе-Эйнштейна. Конденсация Бозе-газа. Температура конденсации. Число частиц в конденсате