Содержание
- 2. Тема урока. Основные положения Молекулярно-кинетической теории (МКТ) 1. Молекулярная физика Молекулярная физика – раздел физики, изучающий
- 3. Еще задолго до нашей эры, в период расцвета древних культур, возникло учение о мельчайших частицах, из
- 4. Древнегреческие философы Анаксагор и Демокрит (в IV веке до нашей эры) считали, что любое вещество состоит
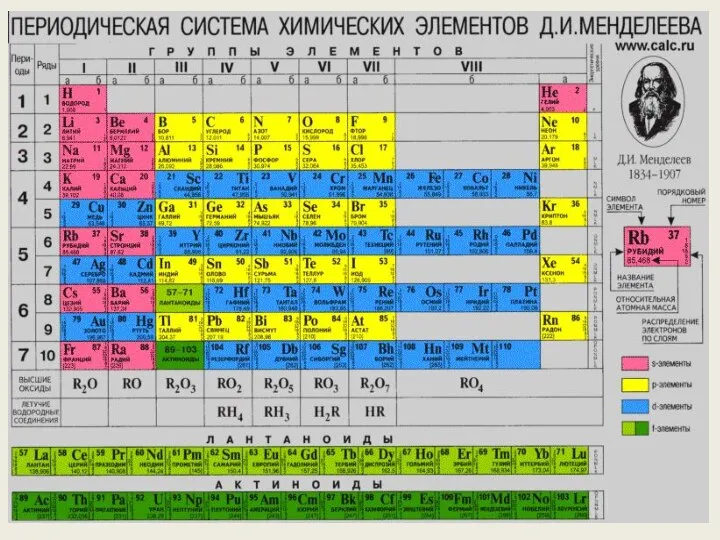
- 5. СОЗДАТЕЛИ АТОМНОЙ ТЕОРИИ Джон Дмитрий Дальтон Менделеев Амедео Эрнест Авогадро Резерфорд
- 6. Этим вращательным движением Ломоносов объяснил тепловые явления. Он утверждал, что «должна существовать наибольшая степень холода, состоящая
- 7. Макроскопические тела (от греч. «макрос» – большой) - это все тела, которые нас окружают: дома, машины,
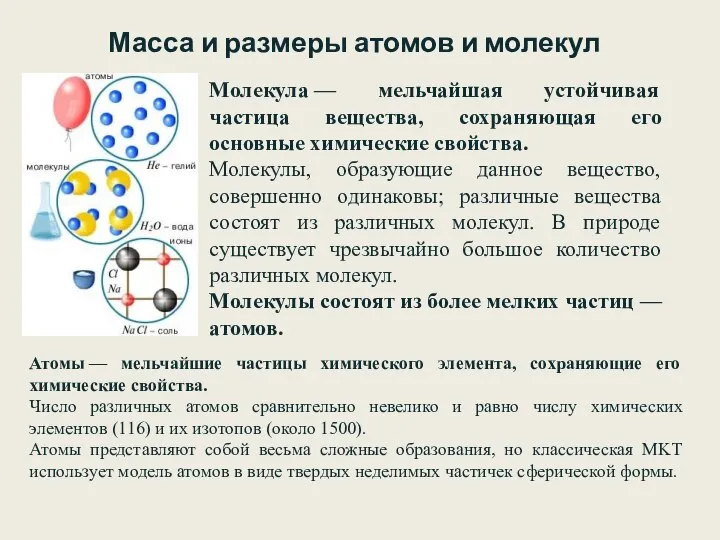
- 8. Все вещества состоят из молекул и атомов. Молекула – наименьшая электронейтральная частица вещества, сохраняющая его свойства.
- 9. ПЕРВОЕ ПОЛОЖЕНИЕ 1. Все вещества – жидкие, твердые и газообразные – образованы из мельчайших частиц –
- 10. ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ I положение 1. Дробление вещества 2. Испарение жидкостей 3. Расширение тел при нагревании
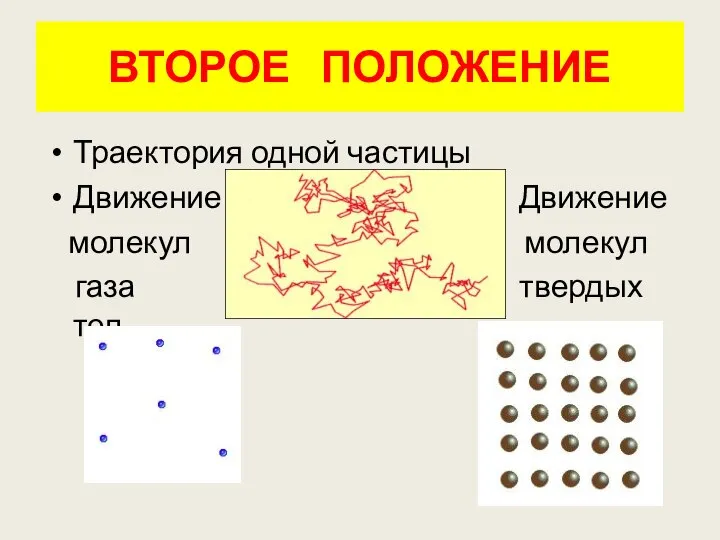
- 11. ВТОРОЕ ПОЛОЖЕНИЕ Траектория одной частицы Движение Движение молекул молекул газа твердых тел
- 12. ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ II положение 1. Диффузия – перемешивание молекул разных веществ 2.Броуновское движение – движение взвешенных
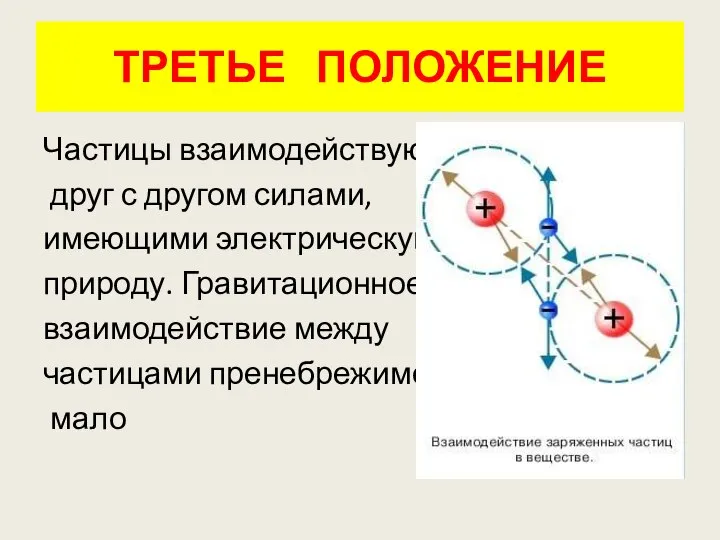
- 13. ТРЕТЬЕ ПОЛОЖЕНИЕ Частицы взаимодействуют друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо
- 14. ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ III положение Силы упругости Прилипание свинцовых цилиндров Смачивание Поверхностное натяжение
- 15. Молекула — мельчайшая устойчивая частица вещества, сохраняющая его основные химические свойства. Молекулы, образующие данное вещество, совершенно
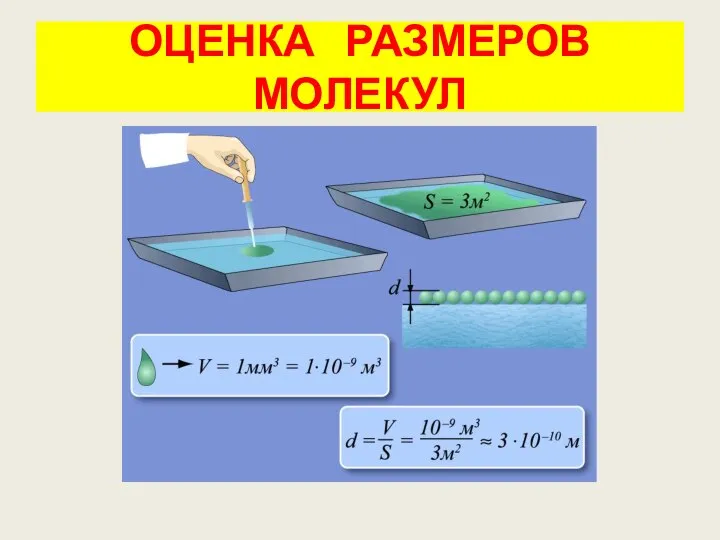
- 16. ОЦЕНКА РАЗМЕРОВ МОЛЕКУЛ
- 17. Масса произвольного атома может быть выражена в атомных единицах массы или в килограммах: 1 а.е.м. =
- 19. Количеством вещества ν называется физическая величина, определяющая число молекул (или атомов, ионов) в данном теле. в
- 20. КОЛИЧЕСТВО ВЕЩЕСТВА Для определения количества вещества в теле сравнивают число молекул (атомов) в нём с числом
- 21. Количество вещества В единице массы, 1 килограмме вещества, находится разное количество структурных единиц – атомов, молекул.
- 22. МОЛЯРНАЯ МАССА Моль - это 6 ·10²³ молекул вещества. В одном моле любого вещества содержится одно
- 23. Физический смысл величин Молярная масса – это масса одного моля. Молярная масса разных веществ различна, т.к.
- 24. Молярная масса Масса вещества m связана с его молярной массой M и количеством вещества ν формулой
- 26. ФОРМУЛЫ
- 27. Молекулярная масса
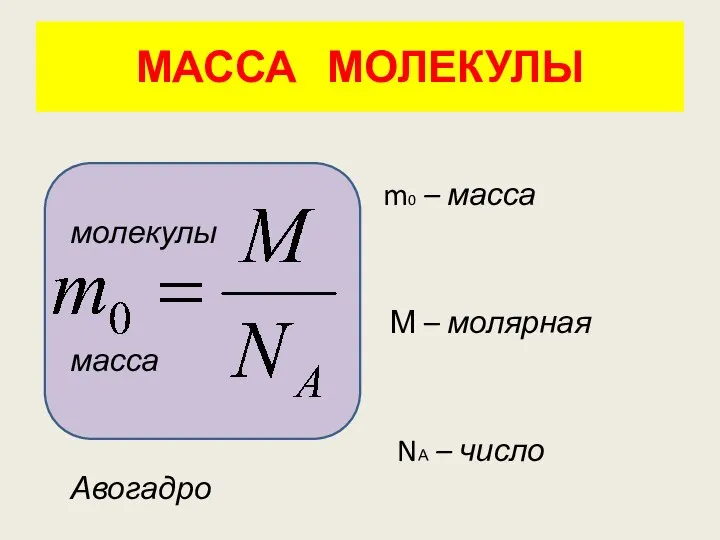
- 28. МАССА МОЛЕКУЛЫ m0 – масса молекулы М – молярная масса NА – число Авогадро
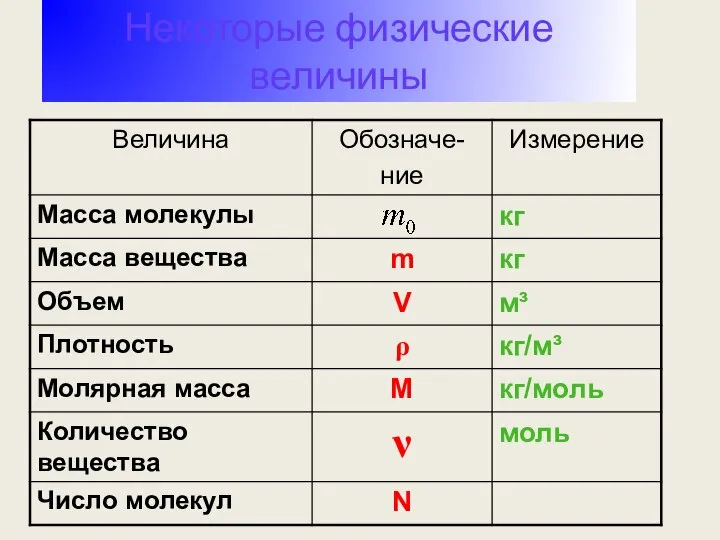
- 29. Некоторые физические величины
- 30. ЗАДАЧИ 1. Рассчитать массу молекулы Н2SО4. М(Н2SО4) = 2·1 + 32 + 16·4 = 98 г/моль
- 31. ЗАДАЧИ 2. Сколько молекул содержится в 50г Аℓ? М(Аℓ) = 27г/моль N = νNA ν =
- 33. Скачать презентацию























 2_Dinamika
2_Dinamika Разделение веществ в хроматографии
Разделение веществ в хроматографии Повышение КПД ГТУ путём внедрения регенеративного цикла
Повышение КПД ГТУ путём внедрения регенеративного цикла Влияние радиоактивных излучений
Влияние радиоактивных излучений Основы проектирования
Основы проектирования Бензиновые двигатели
Бензиновые двигатели Основи термодинаміки
Основи термодинаміки Внутренняя энергия. Теплопередача. Работа в термодинамике
Внутренняя энергия. Теплопередача. Работа в термодинамике 1 начало термодинамики для изопроцессов
1 начало термодинамики для изопроцессов Распространение теплоты в однородных материалах. Теплопроводность однослойной и многослойной плоских стенок. (Занятие 9)
Распространение теплоты в однородных материалах. Теплопроводность однослойной и многослойной плоских стенок. (Занятие 9) Вакуумная, компрессорная техника и пневмосистемы
Вакуумная, компрессорная техника и пневмосистемы Агрегатное состояние вещества
Агрегатное состояние вещества Ресорне підвішування
Ресорне підвішування Поверхностное натяжение
Поверхностное натяжение Графический материал к выпускной квалификационной (бакалаврской) работе на тему: Электроснабжение части села кучугуры
Графический материал к выпускной квалификационной (бакалаврской) работе на тему: Электроснабжение части села кучугуры Классическая теория электропроводности. Законы постоянного тока. Лекция № 13
Классическая теория электропроводности. Законы постоянного тока. Лекция № 13 Подшипники насосов и компрессоров
Подшипники насосов и компрессоров Закон сохранения полной механической энергии
Закон сохранения полной механической энергии Технические данные оборудования, подлежащего реализации
Технические данные оборудования, подлежащего реализации Конденсаторы. Схемы электрической цепи (Тест) (8 класс)
Конденсаторы. Схемы электрической цепи (Тест) (8 класс) Потенциальная энергия
Потенциальная энергия Система движения тележек. Виды тележек
Система движения тележек. Виды тележек Законы сохранения в механике. Решение задач
Законы сохранения в механике. Решение задач Физика в Архитектуре
Физика в Архитектуре Поступательное и вращательное движение тел
Поступательное и вращательное движение тел Микромир элементарных частиц
Микромир элементарных частиц Конвекция Подготовил ученик 8 «Б» класса МБОУ СОШ номер 15 Ахмаджонзода Артур Учитель: Гилевич О.Г.
Конвекция Подготовил ученик 8 «Б» класса МБОУ СОШ номер 15 Ахмаджонзода Артур Учитель: Гилевич О.Г. Электромагнитная индукция
Электромагнитная индукция