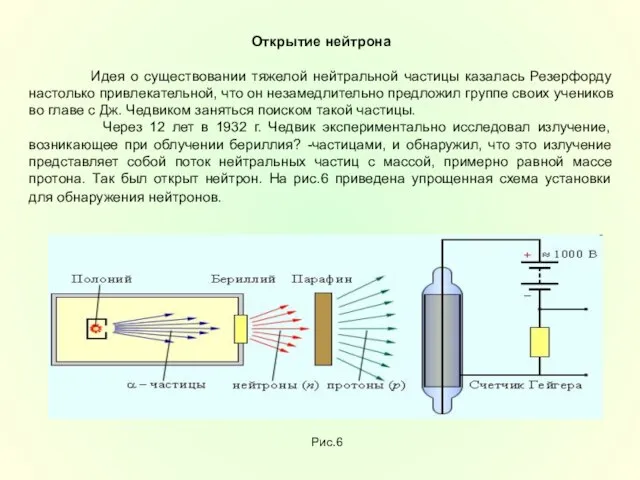
внутри ядер огромными силами, во много раз превосходящими силы кулоновского отталкивания протонов. Силы, удерживающие нуклоны в ядре, называются ядерными ( рис.8)
Особенности ядерных сил:
Ядерные силы примерно в 100 раз превосходят электростатические силы и на десятки порядков превосходят силы гравитационного взаимодействия нуклонов.
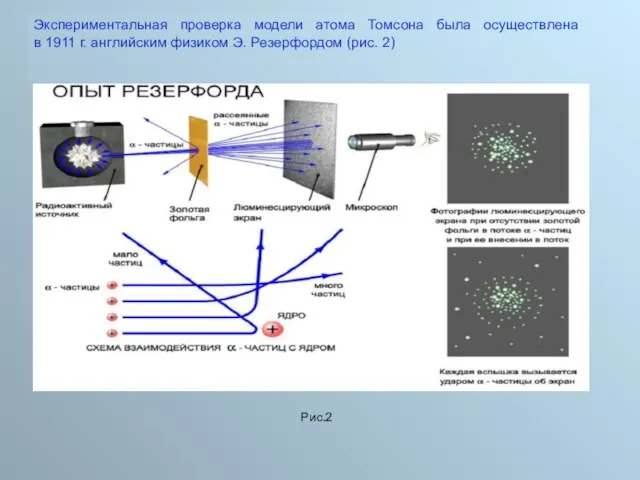
2. Важной особенностью ядерных сил является их короткодействующий характер. Ядерные силы заметно проявляются, как показали опыты Резерфорда по рассеянию
a-частиц, лишь на расстояниях порядка размеров ядра (10–14–10–15 м). Ядерные силы очень быстро спадают с расстоянием. Радиус их действия порядка 0,000 000 000 000 001 метра.
Для этой сверхмалой длины, характеризующей размеры атомных ядер, ввели специальное обозначение Фм (в честь итальянского физика Э. Ферми, 1901-1954)
Все ядра имеют размеры нескольких Ферми.
Радиус ядерных сил равен размеру нуклона, поэтому ядра – концентрация и очень плотной материи. Возможно, самой плотной в земных условиях.
Ядерные силы - сильные взаимодействия.
На больших расстояниях проявляется действие сравнительно медленно убывающих кулоновских сил.
На основании опытных данных можно заключить, что протоны и нейтроны в ядре ведут себя одинаково в отношении сильного взаимодействия, т. е. ядерные силы не зависят от наличия или отсутствия у частиц электрического заряда.
ЯДЕРНЫЕ СИЛЫ
силы притяжения;
действуют между всеми нуклонами в ядре;
короткодействующие.
.
Рис.8








 Криволинейное движение. Движение тела по окружности
Криволинейное движение. Движение тела по окружности Звук. Колебательные системы
Звук. Колебательные системы Отражение света
Отражение света Презентация на тему Внутренняя энергия
Презентация на тему Внутренняя энергия  Механическое движение. Урок физики в 7 классе
Механическое движение. Урок физики в 7 классе Закон Кулона – основной закон электростатики
Закон Кулона – основной закон электростатики Свойства дискретно-временного преобразования Фурье
Свойства дискретно-временного преобразования Фурье Строение атома. Опыт Резерфорда
Строение атома. Опыт Резерфорда Презентация на тему Колебательный контур. Электромагнитные колебания
Презентация на тему Колебательный контур. Электромагнитные колебания  Законы Ньютона. Введение в космодинамику
Законы Ньютона. Введение в космодинамику Композиционные материалы на наноуровне
Композиционные материалы на наноуровне Сопротивление материалов
Сопротивление материалов Движение материальной точки. Задачи
Движение материальной точки. Задачи Решение задач на расчёт КПД теплового двигателя. 8 класс
Решение задач на расчёт КПД теплового двигателя. 8 класс Энергия ядерных превращений. Схемы распада
Энергия ядерных превращений. Схемы распада Сила упругости. Закон Гука. Вес тела
Сила упругости. Закон Гука. Вес тела Приборы управления тормозами
Приборы управления тормозами Передачи механические
Передачи механические Прибор, открывающий тайны
Прибор, открывающий тайны Электромагнитное поле. Электромагнитные волны
Электромагнитное поле. Электромагнитные волны Характеристика твердого состояния вещества. Упругие свойства твердых тел. Закон Гука
Характеристика твердого состояния вещества. Упругие свойства твердых тел. Закон Гука Бином Ньютона
Бином Ньютона Летающие модели
Летающие модели Циклирование фазы
Циклирование фазы Атмосфера. Стратосфера
Атмосфера. Стратосфера Электрические цепи и ее элементы. Тема 1.1.2
Электрические цепи и ее элементы. Тема 1.1.2 Геострофическая адвекция температуры
Геострофическая адвекция температуры Лекция 11. Крутильные колебания стержня
Лекция 11. Крутильные колебания стержня