Содержание
- 2. Агрегатные состояния вещества В обычных условиях любое вещество пребывает в одном из трех состояний – твердом,
- 3. Изменение агрегатного состояния вещества. Плавление. Кристаллизация Плавление и отвердевание Аморфные вещества Переохлаждение Изменение объёма тела при
- 4. Плавление и отвердевание Переход вещества из твердого состояния в жидкое называется плавлением, обратный переход из жидкого
- 5. На рисунке представлен график зависимости температуры льда от полученной теплоты. Q1 – теплота, полученная льдом при
- 6. Аморфные вещества Аморфные вещества (стекло, смола и т.д.) не имеют определенной точки плавления и отвердевания и
- 7. Переохлаждение Если охлаждать жидкость, то она начинает затвердевать при температуре плавления. Иногда удается охладить жидкость ниже
- 8. Изменение объема тела при плавлении и отвердевании При плавлении или отвердевании происходит изменение объема веществ, а
- 9. Зависимость температуры плавления от давления Для веществ, объем которых увеличивается при плавлении, повышение давления затрудняет увеличение
- 10. Испарение и конденсация. Кипение Изменение агрегатного состояния вещества. Испарение и конденсация. Кипение Критическая температура Сублимация Фазовая
- 11. Испарение и конденсация Переход вещества из жидкого состояния в газообразное называется парообразованием. Одним из наиболее распространенных
- 12. Кипение Кипение – это парообразование, которое происходит в объеме всей жидкости и при постоянной температуре. При
- 13. Критическая температура и критическое давление Великий русский ученый Д.И.Менделеев впервые выяснил в 1869г., что не при
- 14. Сублимация Есть и еще один тип фазового перехода — из твердого состояния вещества непосредственно в газообразное
- 15. Фазовая диаграмма Кривая OT, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации. Кривая TK
- 16. Уравнение теплового баланса Многие расчеты процессов теплообмена, в которых происходит плавление (или отвердевание), проводят с помощью
- 17. Примеры решения задач 1. В калориметре находится m = 100 г расплавленного металла галлия при температуре
- 18. 2. Под колоколом воздушного насоса находится вода массы m = 40 г при температуре t0 =
- 19. 3. В калориметре находился лёд массой mл = 0,5 кг при температуре tл = −20 °C.
- 21. Скачать презентацию
Слайд 2Агрегатные состояния вещества
В обычных условиях любое вещество пребывает в одном из
Агрегатные состояния вещества
В обычных условиях любое вещество пребывает в одном из

Чтобы вещество перешло из твердого состояния в жидкое (плавление или таяние), из жидкого в газообразное (кипение или испарение) или из твердого в газообразное (возгонка или сублимация), требуется поступление энергии извне. При обратных процессах (таких, как конденсация или кристаллизация) вещество, напротив, отдает энергию.
Меню
Слайд 3
Изменение агрегатного состояния вещества. Плавление. Кристаллизация
Плавление и отвердевание
Аморфные вещества
Переохлаждение
Изменение объёма тела
Изменение агрегатного состояния вещества. Плавление. Кристаллизация
Плавление и отвердевание
Аморфные вещества
Переохлаждение
Изменение объёма тела

Зависимость температуры плавления от давления
Затвердевание растворов
Меню
Слайд 4Плавление и отвердевание
Переход вещества из твердого состояния в жидкое называется плавлением,
Плавление и отвердевание
Переход вещества из твердого состояния в жидкое называется плавлением,

При кристаллизации происходит сближение частиц, образующих решетку, и их потенциальная энергия уменьшается. При этом жидкость отдает свою энергию внешним телам. Таким образом, единица массы твердого вещества обладает меньшей внутренней энергией, чем единица массы того же вещества в жидком состоянии, даже если их температура одинакова.
Опыт показывает, что температура вещества не меняется, пока происходит плавление или отвердевание. Эта температура называется температурой плавления (отвердевания). Количество тепла, необходимое для плавления тела массы m, равняется:
Q=λm, где λ – удельная теплота плавления – это количество теплоты, необходимое для превращения 1 кг кристаллического вещества в жидкость при той же температуре. Для льда λ= 3,4·105 Дж/кг .
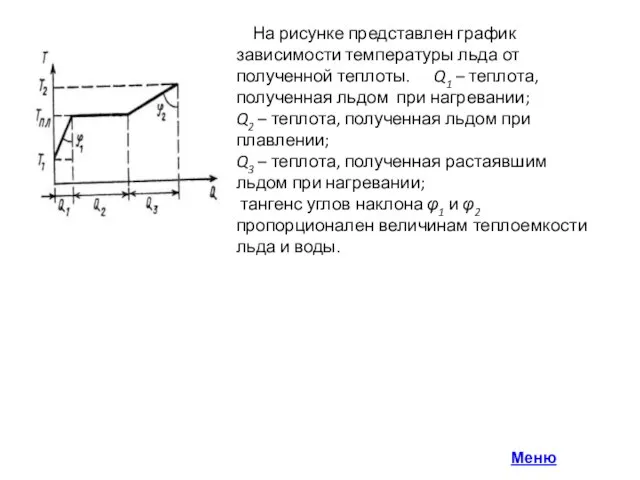
Слайд 5 На рисунке представлен график зависимости температуры льда от полученной теплоты. Q1
На рисунке представлен график зависимости температуры льда от полученной теплоты. Q1
Меню
Слайд 6
Аморфные вещества
Аморфные вещества (стекло, смола и т.д.) не имеют
Аморфные вещества
Аморфные вещества (стекло, смола и т.д.) не имеют

Графики температуры отвердевающих кристаллического и аморфного тел
Меню
Слайд 7Переохлаждение
Если охлаждать жидкость, то она начинает затвердевать при температуре плавления. Иногда
Переохлаждение
Если охлаждать жидкость, то она начинает затвердевать при температуре плавления. Иногда

Для начала кристаллизации необходимы так называемые «центры кристаллизации». Центрами кристаллизации могут служить мелкие, иногда невидимые даже в микроскоп кристаллики (затравка) или посторонние пылинки. Если же центров кристаллизации нет, то может произойти переохлаждение на несколько кельвин даже жидкости с небольшой вязкостью. Важным примером этого является вода. Переохлаждение чистой, без каких-либо пылинок, воды часто наблюдается в природе. Капельки тумана могут не замерзать даже при морозах, достигающих -30°С. Переохлажденная жидкость находится в неустойчивом состоянии; с течением времени под влиянием тех или иных взаимодействий переохлажденная жидкость переходит в более устойчивое при данной температуре кристаллическое состояние.
Меню
Слайд 8Изменение объема тела при плавлении и отвердевании
При плавлении или отвердевании происходит
Изменение объема тела при плавлении и отвердевании
При плавлении или отвердевании происходит

Меню
Слайд 9Зависимость температуры плавления от давления
Для веществ, объем которых увеличивается при плавлении,
Зависимость температуры плавления от давления
Для веществ, объем которых увеличивается при плавлении,

Затвердевание растворов
Температура затвердевания раствора ниже, чем чистого растворителя. При замерзании не очень крепкого раствора замерзает только растворитель. При некоторой определенной концентрации замерзает весь раствор целиком при более низкой температуре.
Меню
Слайд 10Испарение и конденсация. Кипение
Изменение агрегатного состояния вещества.
Испарение и конденсация.
Кипение
Критическая температура
Сублимация
Фазовая диаграмма
Испарение и конденсация. Кипение
Изменение агрегатного состояния вещества.
Испарение и конденсация.
Кипение
Критическая температура
Сублимация
Фазовая диаграмма

Уравнение теплового баланса
Меню
Слайд 11Испарение и конденсация
Переход вещества из жидкого состояния в газообразное называется парообразованием.
Испарение и конденсация
Переход вещества из жидкого состояния в газообразное называется парообразованием.

Очевидно, количество молекул, улетающих с единицы поверхности жидкости в единицу времени, тем больше, чем больше температура жидкости. Улетевшие молекулы уносят с собой энергию, поэтому при испарении происходит уменьшение температуры жидкости (охлаждение). Для поддержания неизменной температуры испаряющейся жидкости к ней необходимо подводить тепло. Количество тепла, которое необходимо сообщить жидкости для ее испарения при постоянной температуре, называется теплотой парообразования:
Q = rm,
где r – удельная теплота парообразования. Она показывает, какое количество тепла нужно затратить, чтобы обратить в пар 1 кг жидкости при неизменной температуре.
Часть подводимой теплоты расходуется на совершение работы против сил притяжения между молекулами при выходе из жидкости и сообщение молекулам кинетической энергии, другая тратится на работу против сил внешнего давления при увеличении объема образовавшегося пара. Величина r уменьшается с увеличением температуры, так как меньше приходится затрачивать энергии на совершение работы выхода. Например, для воды r =2,5·106 Дж/кг при t = 0ºС, при t = 100ºС r =2,26·106 Дж/кг .
В результате хаотического движения над поверхностью жидкости молекулы пара снова могут попасть на эту поверхность и вернуться в жидкость. Этот процесс называется конденсацией пара.
Меню
Слайд 12Кипение
Кипение – это парообразование, которое происходит в объеме всей жидкости и при
Кипение
Кипение – это парообразование, которое происходит в объеме всей жидкости и при

С увеличением температуры окружающей жидкости давление насыщенного пара увеличивается, гидростатическое давление при подъеме пузырька уменьшается. Когда пузырек достигает поверхности жидкости, то давление насыщенного пара в нем практически равно атмосферному давлению на поверхности жидкости и пузырек лопается.
Кипение жидкости происходит при одинаковой температуре всей жидкости, когда давление насыщенного пара равно внешнему давлению. Чем больше внешнее давление, тем выше температура кипения. И наоборот, при уменьшении давления температура кипения понижается. Так, откачивая насосом воздух из сосуда, где находится стакан с водой, можно заставить воду кипеть при комнатной температуре.
Меню
Слайд 13Критическая температура и критическое давление
Великий русский ученый Д.И.Менделеев впервые выяснил в
Критическая температура и критическое давление
Великий русский ученый Д.И.Менделеев впервые выяснил в

Кислород и другие газы при обычных температурах не могут быть обращены в жидкое состояние, какому бы давлению их не подвергали, потому, что их температура при этом значительно выше критической. Если поместить жидкость в замкнутый сосуд и нагревать ее, то упругость паров, полученных из этой жидкости, будет расти с ростом температуры. Одновременно будет расти и плотность паров, а плотность жидкости будет уменьшаться, пока различие между паром и жидкостью будет уменьшаться, пока различие между паром и жидкостью исчезнет. Давление, при котором исчезает различие между паром и жидкостью, находящихся при критической температуре, называется критическим. Например критическая температура углекислого газа + 31,1°С, а критическое давление 73 ат. Критическая температура аммиака + 132°С, а критическое давление 109 ат. Состояние, в котором находится вещество при критической температуре и критическом давлении, называется критическим. В критическом состоянии жидкость и ее пар становятся неразличимыми. Удельная теплота парообразования при критической температуре становится равной нулю.
Меню
Слайд 14Сублимация
Есть и еще один тип фазового перехода — из твердого состояния вещества
Сублимация
Есть и еще один тип фазового перехода — из твердого состояния вещества

Примером обратного процесса образования кристаллов из паров является образование инея и снежинок из водяных паров воздуха.
Меню
Слайд 15Фазовая диаграмма
Кривая OT, соответствующая равновесию между твердой и газообразной фазами, называется
Фазовая диаграмма
Кривая OT, соответствующая равновесию между твердой и газообразной фазами, называется

Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.
Типичная фазовая диаграмма вещества.
K – критическая точка, T – тройная точка.
Область I – твердое тело, область II – жидкость, область III – газообразное вещество.
Меню
Слайд 16Уравнение теплового баланса
Многие расчеты процессов теплообмена, в которых происходит плавление
Уравнение теплового баланса
Многие расчеты процессов теплообмена, в которых происходит плавление

Qл – Qв = mхλ, или mх = 200 г.
Таким образом, в калориметре образуется смесь из (m1 + m2 – mх) = 400 г воды и (mл + mх) = 600 г льда, находящегося при температуре 0⁰С.
Меню
Слайд 17Примеры решения задач
1. В калориметре находится m = 100 г расплавленного металла
Примеры решения задач
1. В калориметре находится m = 100 г расплавленного металла

Решение. При отвердевании галлия выделяется теплота кристаллизации, что приводит к нагреванию системы до температуры плавления галлия tпл = 29,8 °C, поскольку только при этой температуре жидкий и твёрдый галлий будут находиться в равновесии.
Количество теплоты, выделяющееся при отвердевании массы m1 галлия, равно λm1. Оно идёт на нагревание всего галлия до температуры плавления; для этого требуется количество теплоты cm(tпл — t). Следовательно,
m1 = cm(tпл — t) / λ ≈ 5,1 г.
Заметим, что если бы переохлаждение было очень сильным, то теплоты кристаллизации могло бы не хватить для нагревания всей массы галлия до температуры плавления. Однако, поскольку m1 < m, то в нашем случае галлий действительно нагреется до этой температуры.
Слайд 182. Под колоколом воздушного насоса находится вода массы m = 40 г
2. Под колоколом воздушного насоса находится вода массы m = 40 г

Решение. Испарившаяся вода имеет массу m–mл. На ее испарение требуется количество теплоты Q = (m–mл) L. При быстром откачивании теплота от окружающих тел не успевает передаться воде. Поэтому все это количество теплоты получается при образовании льда, т.е. Q = mл λ.
Следовательно,
(m–mл) L = mл λ
и
mл = mL/( λ + L) = 35 г.
Меню
Слайд 193. В калориметре находился лёд массой mл = 0,5 кг при температуре
3. В калориметре находился лёд массой mл = 0,5 кг при температуре

Решение. Сначала нужно выяснить, что будет находиться в калориметре в конечном состоянии - только лёд, смесь льда и воды или только вода. Сравниваем количества теплоты, которые входят в уравнение теплового баланса, в первом случае. Теплота, выделяющаяся при конденсации всего пара, равна
Q1 = Lmп = 132 кДж.
Меню
 Орфографическая зоркость
Орфографическая зоркость Презентация на тему Последовательное соединение проводников (8 класс)
Презентация на тему Последовательное соединение проводников (8 класс)  Проводники и диэлектрики в электрическом поле
Проводники и диэлектрики в электрическом поле Моделирование процессов преобразования сигналов и помех линейными и нелинейными звеньями
Моделирование процессов преобразования сигналов и помех линейными и нелинейными звеньями Трение в живой природе
Трение в живой природе Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Конструкционные материалы. Классификация. Свойства
Конструкционные материалы. Классификация. Свойства Термодинамика. Лекция 6
Термодинамика. Лекция 6 Волновые свойства света
Волновые свойства света Движение небесных тел под действием сил тяготения
Движение небесных тел под действием сил тяготения Путь от Солнца к сознанию. Базовые понятия
Путь от Солнца к сознанию. Базовые понятия Магнитное поле. Магнитное поле прямого тока. Магнитные линии
Магнитное поле. Магнитное поле прямого тока. Магнитные линии Pneumatic Hydraulic Jack Switch
Pneumatic Hydraulic Jack Switch Закон Гесса. Лекция 4
Закон Гесса. Лекция 4 Электрическое поле в веществе
Электрическое поле в веществе Теорема о движении центра масс
Теорема о движении центра масс Постоянный ток и его основные законы
Постоянный ток и его основные законы Техническая механика. Термины и определения
Техническая механика. Термины и определения Расчет критического теплового потока
Расчет критического теплового потока Степень окисления
Степень окисления Методы и средства автоматического регулирования теплового состояния судовых ДВС
Методы и средства автоматического регулирования теплового состояния судовых ДВС Превращение энергии
Превращение энергии Закон сохранения момента импульса
Закон сохранения момента импульса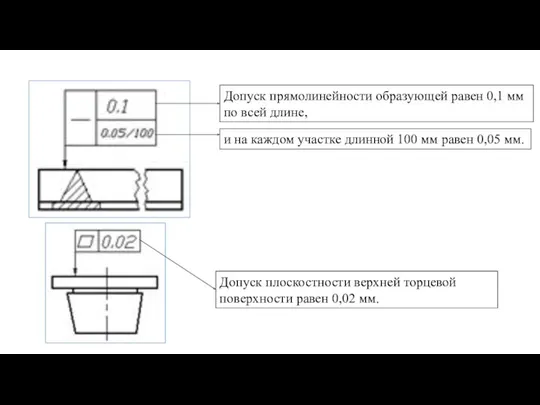 Отклонения формы и расположения
Отклонения формы и расположения Әр түрлі ортадағы
Әр түрлі ортадағы Испарение и конденсация
Испарение и конденсация Воздухоплавание
Воздухоплавание Построение изображения в линзах
Построение изображения в линзах