Содержание
- 2. - Радиоактивность – способность атомных ядер самопроизвольно превращаться в другие ядра с испусканием частиц. «Радио» -
- 3. 1896г - открыл явление радиоактивности (способность атомов некоторых химических элементов к самопроизвольному излучению) Анри Беккерель
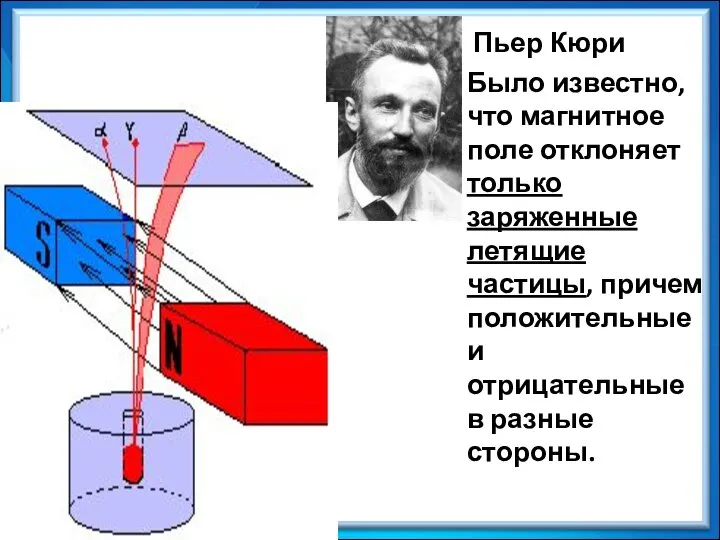
- 4. Пьер Кюри Было известно, что магнитное поле отклоняет только заряженные летящие частицы, причем положительные и отрицательные
- 5. β-лучи - поток электронов – отрицательно заряженные частицы. a-лучи заряжены положительно, - это атомы гелия, они
- 6. a - - частица – ионизированные ядра атома гелия. Масса - 6,644656⋅10 −27 кгα - лучи
- 7. b - b - частицы поток электронов – отрицательно заряженные частицы, движущиеся со скоростями, близкими к
- 8. А в 1900 году Вилларом была открыта еще одна составляющая, гамма-лучи (γ). γ - лучи представляют
- 9. Применение Гамма-излучения В технике, например для обнаружения дефектов в металлических деталях – гамма-дефектоскопия. В радиационной химии
- 10. Радиоактивность являлась привилегией самых тяжелых элементов периодической системы Д.И.Менделеева. Среди элементов, содержащихся в земной коре, радиоактивными
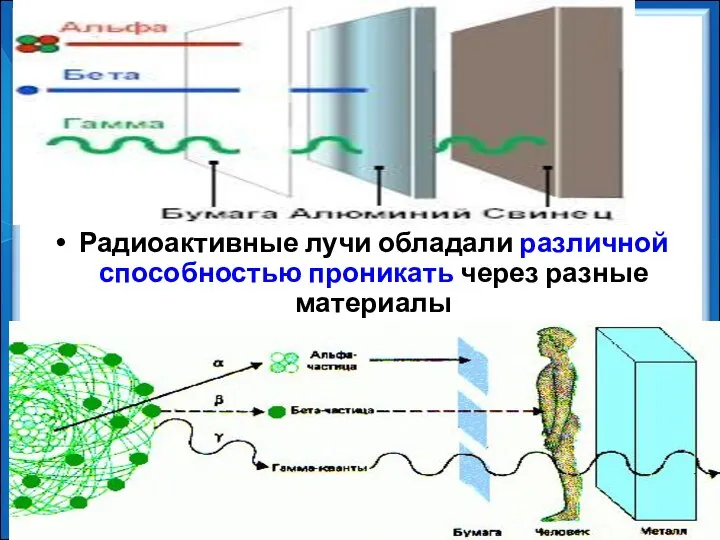
- 11. Радиоактивные лучи обладали различной способностью проникать через разные материалы
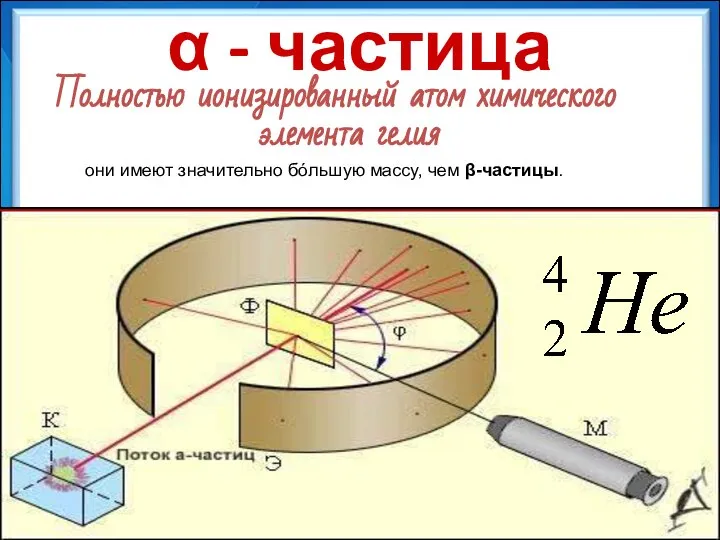
- 12. α - частица Полностью ионизированный атом химического элемента гелия они имеют значительно бóльшую массу, чем β-частицы.
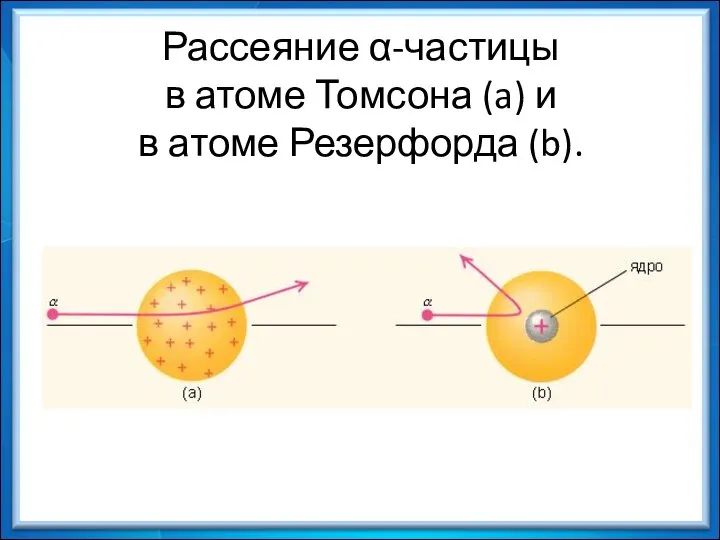
- 13. Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b).
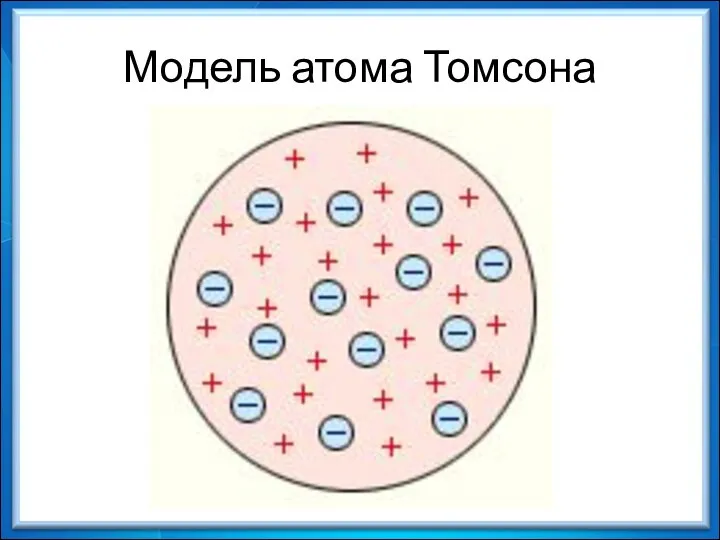
- 14. Модель атома Томсона
- 15. Планетарная (ядерная) модель атома Атом – микрочастица, состоящая из положительно заряженного ядра и окружающих его электронов.
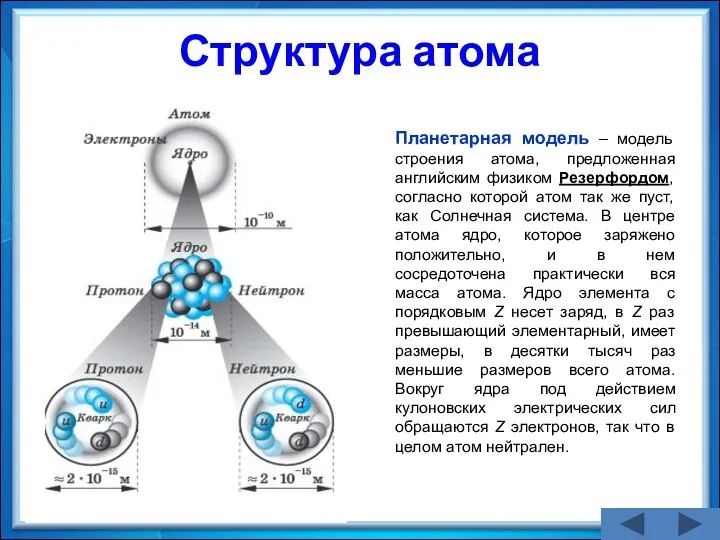
- 16. Структура атома Планетарная модель – модель строения атома, предложенная английским физиком Резерфордом, согласно которой атом так
- 17. Противоречие модели Томсона с экспериментом: 1. Так как масса электронов мала, они не могут заметно изменить
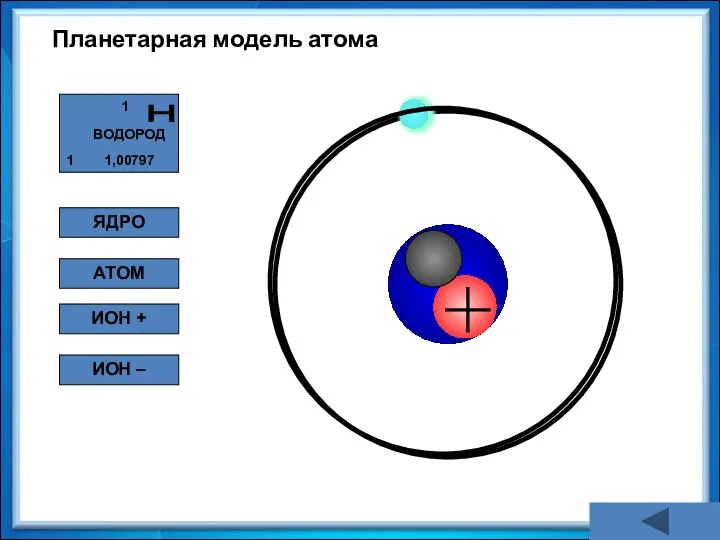
- 18. Планетарная модель атома ЯДРО АТОМ ИОН + ИОН –
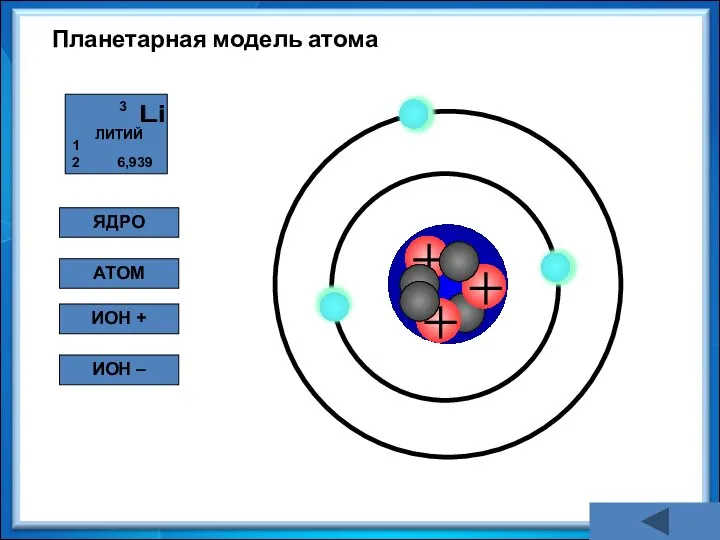
- 19. Планетарная модель атома ЯДРО АТОМ ИОН + ИОН –
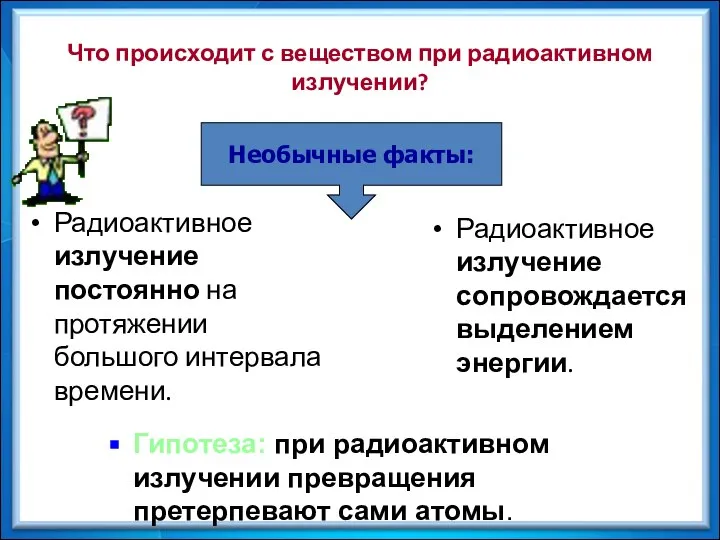
- 20. Что происходит с веществом при радиоактивном излучении? Радиоактивное излучение сопровождается выделением энергии. Радиоактивное излучение постоянно на
- 21. Фредерик Содди 1877 - 1956 Эрнест Резерфорд 1871–1937 В 1903 г. обнаружили, что радий превращается в
- 22. Обозначение ядер химических элементов - Зарядовое число - Номер химического элемента - Заряд ядра в элементарных
- 23. Обозначение ядер химических элементов и частиц Примеры: Частицы:
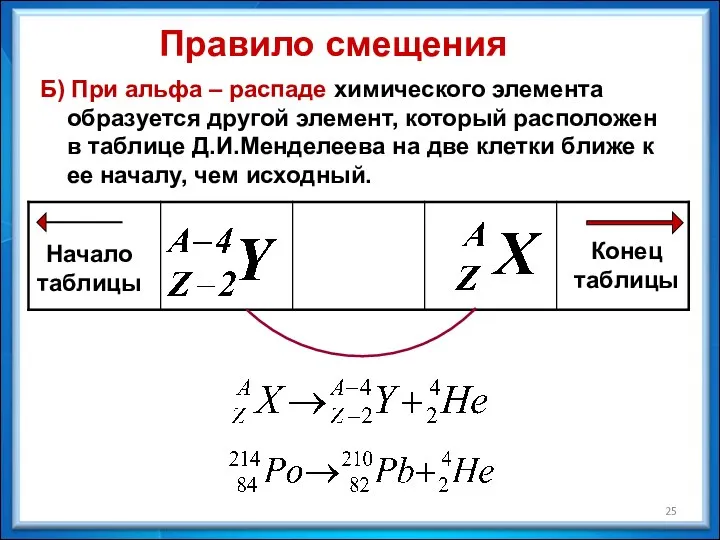
- 24. Правила смещения А) Альфа – распад: зарядовое число (порядковый номер) элемента уменьшается на две единицы, а
- 25. Б) При альфа – распаде химического элемента образуется другой элемент, который расположен в таблице Д.И.Менделеева на
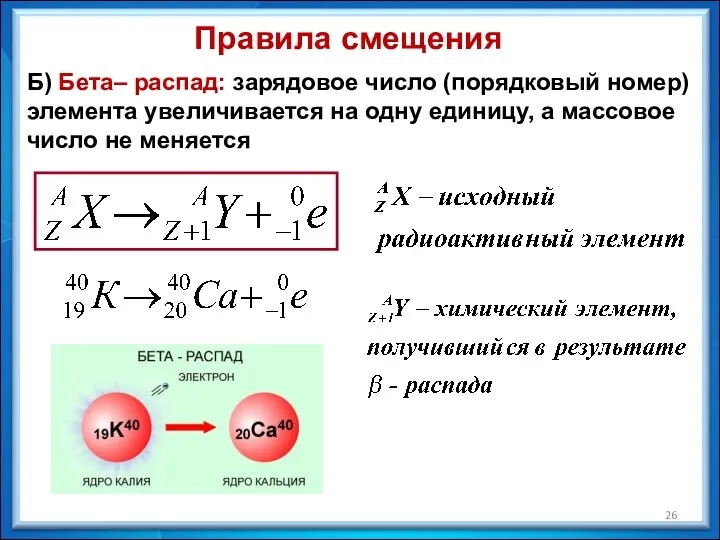
- 26. Правила смещения Б) Бета– распад: зарядовое число (порядковый номер) элемента увеличивается на одну единицу, а массовое
- 27. Правило смещения Б) При бета – распаде одного химического элемента образуется другой элемент, который расположен в
- 28. Законы сохранения массового числа и заряда при радиоактивных превращениях
- 30. Скачать презентацию
















 От чего зависит количество одинаковых изображенний в калейдоскопе?
От чего зависит количество одинаковых изображенний в калейдоскопе? Гидрогазодинамика. Потери напора на местных гидравлических сопротивлениях. Лекция 3
Гидрогазодинамика. Потери напора на местных гидравлических сопротивлениях. Лекция 3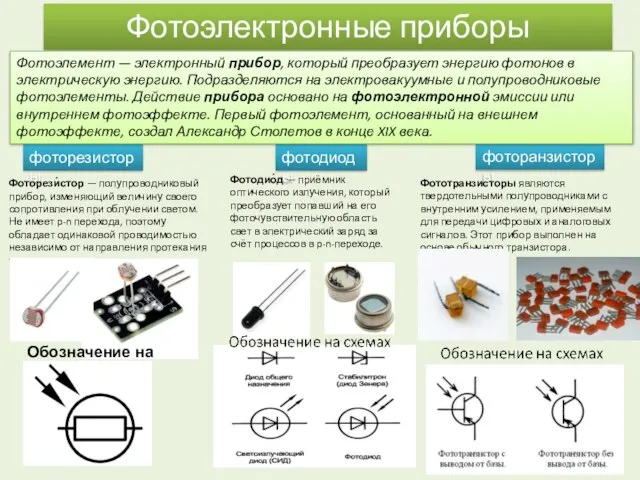 Фотоэлектронные приборы
Фотоэлектронные приборы Взаимодействие тел
Взаимодействие тел Электрические явления 8 класс
Электрические явления 8 класс Волновые свойства света
Волновые свойства света Законы сохранения в механике
Законы сохранения в механике Теория движения военных колесных машин. Лекция 3
Теория движения военных колесных машин. Лекция 3 Давление тел
Давление тел Обозначения в электрической цепи
Обозначения в электрической цепи Бури. Скорость бури
Бури. Скорость бури Рисунки к методичке по теплообменнику
Рисунки к методичке по теплообменнику Курс физики.Основы квантовой физики. Часть 2
Курс физики.Основы квантовой физики. Часть 2 Динамика материальной точки. Динамика. Законы Ньютона. Силы в природе
Динамика материальной точки. Динамика. Законы Ньютона. Силы в природе Случайные фракталы
Случайные фракталы Задачи на массу и плотность
Задачи на массу и плотность Рентгеновское излучение. 9 класс
Рентгеновское излучение. 9 класс Полупроводники. Свойства полупроводников
Полупроводники. Свойства полупроводников Основы термодинамики. Лекция 2.3
Основы термодинамики. Лекция 2.3 Магнитное поле кругового тока
Магнитное поле кругового тока Магнитные поля
Магнитные поля Работа силы упругости. Потенциальная энергия упруго деформированного тела
Работа силы упругости. Потенциальная энергия упруго деформированного тела Основные понятия и задачи кинематики (продолжение)
Основные понятия и задачи кинематики (продолжение) Гальваномагнитные свойства тонких пленок висмута, легированных оловом, в интервале температуры 77-300 К
Гальваномагнитные свойства тонких пленок висмута, легированных оловом, в интервале температуры 77-300 К Физика космоса, кружок. Космология в ОТО
Физика космоса, кружок. Космология в ОТО Уровнемеры. Задачи и способы измерения и контроля уровня жидкости
Уровнемеры. Задачи и способы измерения и контроля уровня жидкости Электризация тел. Электрический заряд. Закон сохранения электрического заряда
Электризация тел. Электрический заряд. Закон сохранения электрического заряда Биологические эффекты воздействия ионизирующей радиации. Последствия Чернобыльской аварии на территории Воронежской области
Биологические эффекты воздействия ионизирующей радиации. Последствия Чернобыльской аварии на территории Воронежской области