Содержание
- 2. Лекция № 1. Строение атома Структура лекции: § 1.1. Опыт Резерфорда. Ядерная модель атома. § 1.2.
- 3. § 1.1. Опыт Резерфорда. Ядерная модель атома План: Модель атома Томсона и Резерфорда. Опыты Томсона и
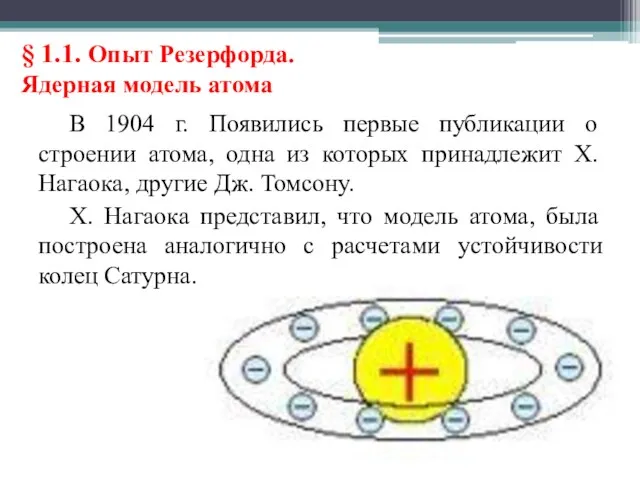
- 4. § 1.1. Опыт Резерфорда. Ядерная модель атома В 1904 г. Появились первые публикации о строении атома,
- 5. Хантаро Нагаока (1865 – 1950) – японский физик, один из основоположников японской физики начала Периода Мэйдзи,
- 6. § 1.1. Опыт Резерфорда. Ядерная модель атома Дж. Томсон считал, что атом представляет собой электронейтральную систему
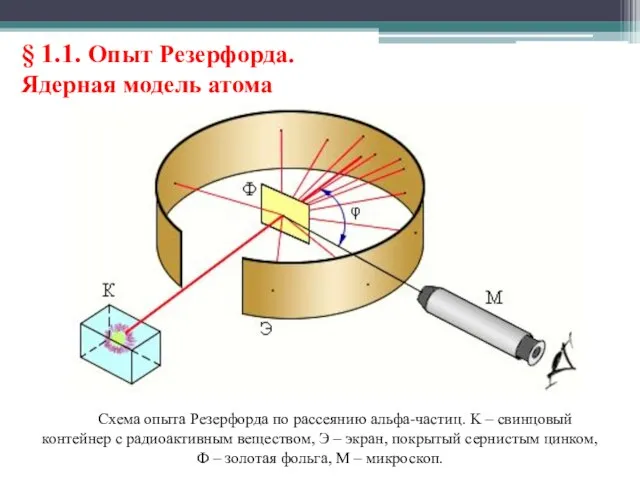
- 7. § 1.1. Опыт Резерфорда. Ядерная модель атома Первые прямые эксперименты по исследованию внутренней структуры атомов были
- 8. § 1.1. Опыт Резерфорда. Ядерная модель атома Схема опыта Резерфорда по рассеянию альфа-частиц. K – свинцовый
- 9. Эрнест Марсден (1889 – 1970) – новозеландский физик. Совместно с Х. Гейгером в 1909 – 1910
- 10. Ханс Вильгельм Гейгер (1882 – 1945) – немецкий физик, первым создавший детектор альфа-частиц и других ионизирующих
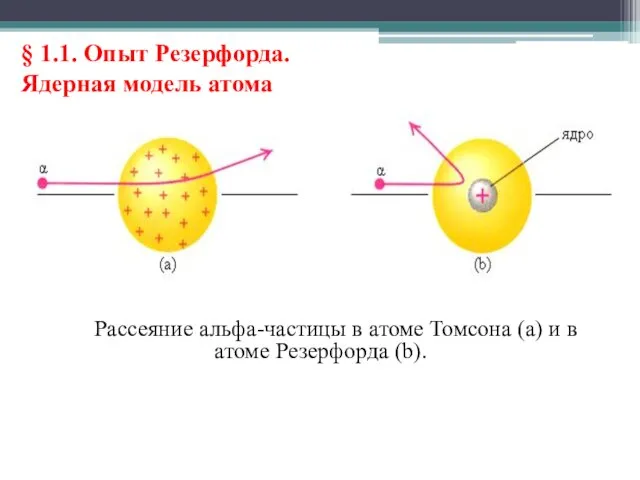
- 11. § 1.1. Опыт Резерфорда. Ядерная модель атома Рассеяние альфа-частицы в атоме Томсона (a) и в атоме
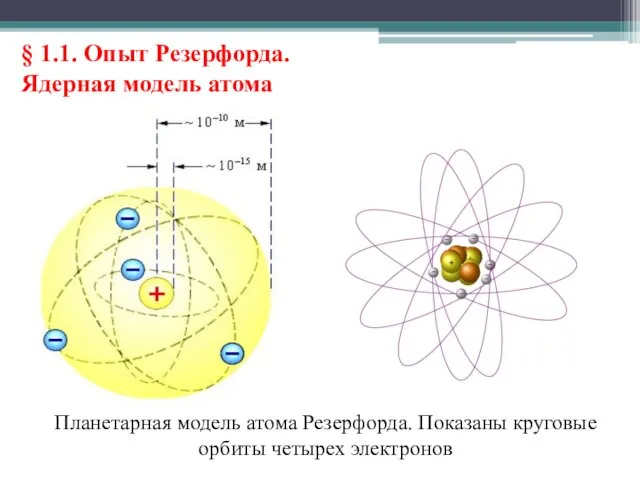
- 12. § 1.1. Опыт Резерфорда. Ядерная модель атома Выводы о строении атома, следовавшие из опытов Резерфорда, заставляли
- 13. § 1.1. Опыт Резерфорда. Ядерная модель атома Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов
- 14. § 1.2. Квантовые постулаты Бора План: Теория Н. Бора. Квантовые постулаты Н. Бора.
- 15. § 1.2. Квантовые постулаты Бора Планетарная модель атома, Резерфорда – попытка применения классических представлений о движении
- 16. Нильс Хенрик Давид Бор (1885 – 1962) – датский физик-теоретик и общественный деятель, один из создателей
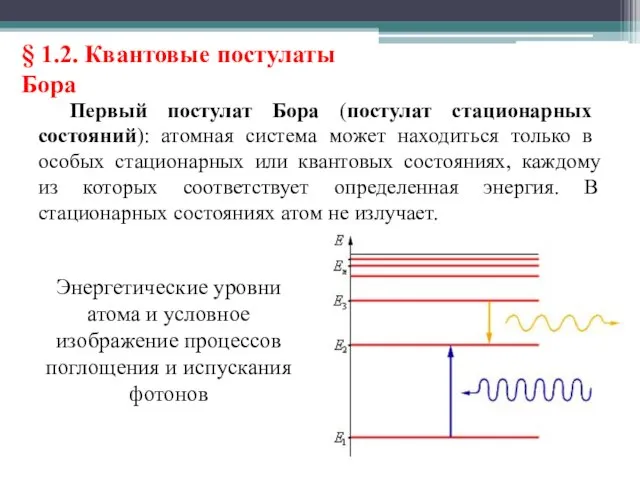
- 17. § 1.2. Квантовые постулаты Бора Первый постулат Бора (постулат стационарных состояний): атомная система может находиться только
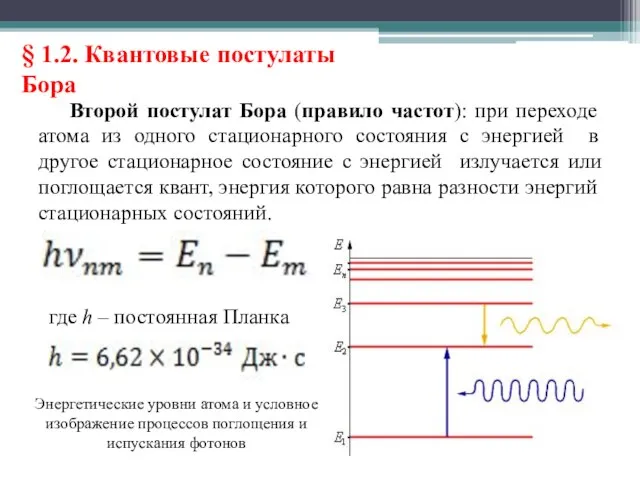
- 18. § 1.2. Квантовые постулаты Бора Второй постулат Бора (правило частот): при переходе атома из одного стационарного
- 19. § 1.3. Атом водорода. Линейчатые спектры План: Теория Бора для атома водорода. Спектральные линии и энергетические
- 20. § 1.3. Атом водорода. Линейчатые спектры Простейший из атомов, атом водорода явился своеобразным тест-объектом для теории
- 21. § 1.3. Атом водорода. Линейчатые спектры Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра,
- 22. § 1.3. Атом водорода. Линейчатые спектры Правило квантования, приводящее к согласующимся с опытом значениям энергий стационарных
- 23. § 1.3. Атом водорода. Линейчатые спектры Скорость электрона, вращающегося по круговой орбите некоторого радиуса в кулоновском
- 24. § 1.3. Атом водорода. Линейчатые спектры Стационарные орбиты атома водорода
- 25. § 1.3. Атом водорода. Линейчатые спектры Диаграмма энергетических уровней атома водорода
- 26. § 1.4. Лазеры План: Оптические квантовый генератор. Устройство квантовых генераторов.
- 27. § 1.4. Лазеры Лазеры или оптические квантовые генераторы – современные источники когерентного излучения, обладающие целым рядом
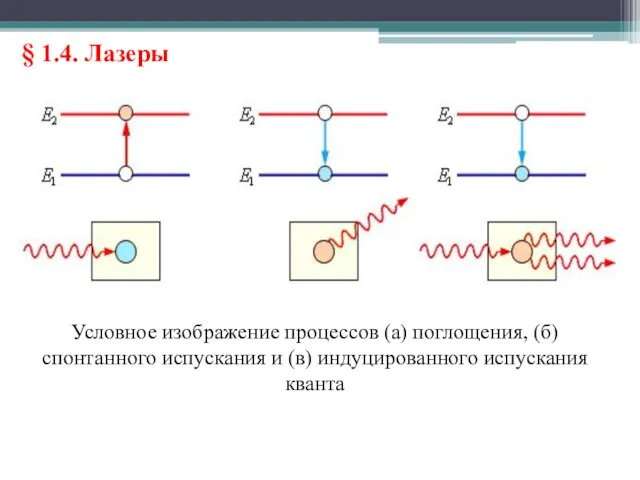
- 28. § 1.4. Лазеры В 1916 г. А. Эйнштейн предсказал, что переход электрона в атоме с верхнего
- 29. § 1.4. Лазеры Условное изображение процессов (a) поглощения, (б) спонтанного испускания и (в) индуцированного испускания кванта
- 30. Вопросы для закрепления материала На тему «Строение атома» Каковы результаты опытов Томсона и Резерфорда? Почему положительно
- 32. Скачать презентацию






















 Что изучает физика!
Что изучает физика! Презентация на тему Виды сил. Равнодействующая сила. Правила сложения сил
Презентация на тему Виды сил. Равнодействующая сила. Правила сложения сил  Определение расстояния до недоступной точки
Определение расстояния до недоступной точки Закон сохранения механической энергии
Закон сохранения механической энергии Система обнаружения и блокировки излучения радиосигнала
Система обнаружения и блокировки излучения радиосигнала Силы инерции. Лекция 9
Силы инерции. Лекция 9 Три состояния вещества
Три состояния вещества Приемы резания и зачистки тонколистового металла и проволоки
Приемы резания и зачистки тонколистового металла и проволоки Затухающие колебания. Лекция 26
Затухающие колебания. Лекция 26 Плотность вещества (7 класс)
Плотность вещества (7 класс) Условия плавания тел
Условия плавания тел Структура и содержание контрольных измерительных материалов ЕГЭ по физике
Структура и содержание контрольных измерительных материалов ЕГЭ по физике Механическое движение. Повторение
Механическое движение. Повторение Презентация на тему Термоядерные реакции
Презентация на тему Термоядерные реакции  Тест
Тест Атомы. Молекулы. Вещества Изотопы
Атомы. Молекулы. Вещества Изотопы Схема разрывной машины с рычажно-маятниковым силоизмерителем
Схема разрывной машины с рычажно-маятниковым силоизмерителем Строение атомного ядра, радиоактивность
Строение атомного ядра, радиоактивность Входные геоэлектрические модели геологических сред с наличием зоны ГРП
Входные геоэлектрические модели геологических сред с наличием зоны ГРП Малоизвестные факты об электричестве
Малоизвестные факты об электричестве Движение тела по наклонной плоскости. Решение задач
Движение тела по наклонной плоскости. Решение задач Основные сведения об измерении давления
Основные сведения об измерении давления Решение задач на расчет электрических цепей
Решение задач на расчет электрических цепей Динамика материальной точки
Динамика материальной точки Состояние вещества. Тест
Состояние вещества. Тест Машиностроительный комплекс России
Машиностроительный комплекс России Механика. Кинематика
Механика. Кинематика 1435976
1435976