Слайд 2История изучения строения атома
Представление об атомах как неделимых мельчайших частицах веществ возникло

еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века учение об атомах, будучи материалистическим, не получило признания. К началу XVIII в. атомистическая теория приобретает все большую популярность. К этому времени работами французского химика А. Лавуазье (1743–1794), великого русского ученого М.В. Ломоносова и английского химика и физика Д. Дальтона (1766–1844) была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы считались неделимыми.
Слайд 3История изучения строения атома
Большую роль в развитии атомистической теории сыграл выдающийся русский

химик Д.И. Менделеев, разработавший в 1869 г. периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Существование закономерной связи между всеми химическими элементами, ярко выраженное в периодической системе Менделеева, наталкивает на мысль о том, что в основе строения всех атомов лежит общее свойство: все они находятся в близком родстве друг с другом.
Слайд 4История изучения строения атома
Однако до конца XIX в. в химии господствовало метафизическое

убеждение, что атом есть наименьшая частица простого вещества, последний предел делимости материи. При всех химических превращениях разрушаются и вновь создаются только молекулы, атомы же остаются неизменными и не могут дробиться на более мелкие части.
Различные предположения о строении атома долгое время не подтверждались какими-либо экспериментальными данными. Лишь в конце XIX в. были сделаны открытия, показавшие сложность строения атома и возможность превращения при определенных условиях одних атомов в другие. На основе этих открытий начало быстро развиваться учение о строении атома.
Слайд 5История изучения строения атома
Наиболее ярким свидетельством сложного строения атомов явилось открытие явления

радиоактивности, сделанное французским физиком Анри Беккерелем в 1896г. Беккерель обнаружил, что элемент уран самопроизвольно излучает ранее неизвестные невидимые лучи, которые позже были названы радиоактивным излучением. В июле и декабре 1898 года Мария Склодовская-Кюри и Пьер Кюри объявили об открытии двух новых элементов, которые они назвали полонием Po и радием Ra. Эти элементы были названы радиоактивными, а само явление – радиоактивностью.
Слайд 6История изучения строения атома
В 1899г. было обнаружено, что радиоактивное излучение радия неоднородно,

т.е. оно имеет сложный состав. Положительно заряженные частицы назвали альфа-частицами, отрицательно заряженные – бета-частицами, а нейтральные – гамма-частицами или гамма-квантами (фотонами).
Слайд 7История изучения строения атома
Некоторое время спустя в результате исследования различных физических характеристик

и свойств этих частиц удалось установить, что β-частица представляет собой электрон, а α-частица – полностью ионизированный атом элемента гелия (т.е. атом гелия, потерявший оба электрона). Выяснилось также, что ϒ-излучение представляет собой один из видов электромагнитного излучения.
Слайд 8История изучения строения атома
Особенно важный вклад в создание теории строения атома внёс

английский физик Эрнест Резерфорд (1871 – 1937), который проводил опыты по изучению прохождения альфа-частиц через тонкие металлические пластины золота и платины. Большинство альфа-частиц проходило сквозь золотую фольгу без заметного изменения направления их движения. Однако некоторые частицы отклонялись на большие углы от первоначального направления и даже отбрасывались назад, что могло вызывать положительно заряженная частица атома – атомное ядро. Атомное ядро – это тело малых размеров, в котором сконцентрированы почти вся масса и весь положительный заряд атома. Вокруг ядра находятся отрицательно заряженные электроны.
Слайд 9История изучения строения атома
Позднее было установлено, что ядра атомов состоят из положительно

заряженных частиц – протонов и нейтральных частиц – нейтронов. Сумму протонов и нейтронов называют массовым числом. Протоны, нейтроны и электроны – это элементарные частицы.
Слайд 10Строение атома элемента и его положение в ПСХЭ
Число протонов N(p+) равно заряду

ядра (Z) и порядковому номеру элемента в периодической системе элементов. N(p+) = Z Электронная оболочка атома состоит из движущихся вокруг ядра электронов (е-). Число электронов в электронной оболочке нейтрального атома равно числу протонов в его ядре.
Слайд 11Строение атома элемента и его положение в ПСХЭ
Таким образом, зная порядковый номер

элемента, можно определить строение его атома. Например, порядковый номер элемента натрия 11, значит, заряд ядра его атома +11. Следовательно, вокруг ядра вращается 11 электронов, имеющих общий отрицательный заряд -11.
Слайд 12Изотопы
Массовые числа атомов одного и того же элемента могут различаться. Например, природный

кислород имеет атомы с массовыми числами 16,17,18. Это связано с тем, что число протонов в ядре атома любого элемента всегда постоянно, но число нейтронов может быть разным. В ядрах атомов кислорода число протонов равно 8, а вот нейтронов соответственно 8,9,10 (16-8=8; 17-8=9; 18-8=10).
Слайд 13Изотопы
Это разновидности атомов одного и того же химического элемента, имеющие одинаковое число

протонов, но разное число нейтронов в ядре. Поэтому, химический элемент – это вид атомов с одинаковым зарядом ядра.
Слайд 14Изотопы
Относительная атомная масса химического элемента рассчитывается как средняя масса его изотопов с

учётом их распространённости в природе. Поэтому относительная атомная масса часто не является целым числом. Для расчета относительной атомной массы элемента, представленного в природе в виде смеси изотопов, необходимо умножить процент каждого изотопа на его атомную массу и сложить их вместе, разделив затем на число изотопов.
Слайд 15Изотопы
Исходя из этого, становится понятным тот факт, что в некоторых случаях у

элементов с большим порядковым номером атомная масса меньше, чем у элементов с меньшим порядковым номером, например, аргон Ar и калий К, теллур Te и иод I. Это зависит от того, какие изотопы преобладают в данном элементе: тяжелые или легкие. Элемент калий состоит преимущественно из более легких изотопов, а аргон – из более тяжелых. Кроме того, элементы располагаются в ПСХЭ на основании их свойств и принадлежности к тому или иному семейству.














 Основи термодинаміки
Основи термодинаміки Презентация на тему Физика вокруг нас
Презентация на тему Физика вокруг нас  Классификация химических, физических и механических свойств порошка
Классификация химических, физических и механических свойств порошка Электрическое поле
Электрическое поле Разгон
Разгон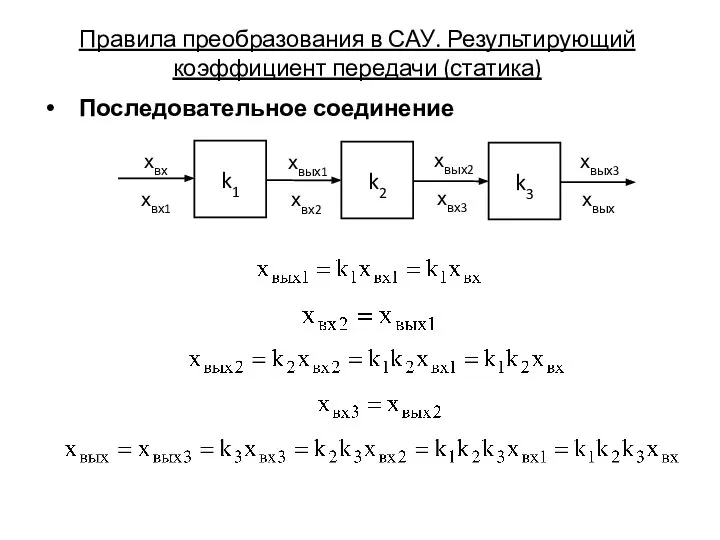 Правила преобразования в САУ. Результирующий коэффициент передачи (статика)
Правила преобразования в САУ. Результирующий коэффициент передачи (статика) Электрический заряд
Электрический заряд Определение коэффициента поверхностного натяжения жидкости методом капиллярных явлений и методом отрыва капель
Определение коэффициента поверхностного натяжения жидкости методом капиллярных явлений и методом отрыва капель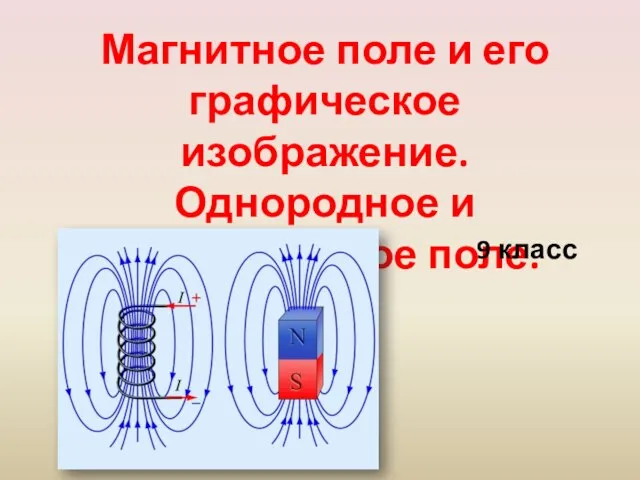 Магнитное поле и его графическое изображение. Однородное и неоднородное поле
Магнитное поле и его графическое изображение. Однородное и неоднородное поле Аккумулирование энергии
Аккумулирование энергии Презентация на тему Изобретатель радио – А.С. Попов
Презентация на тему Изобретатель радио – А.С. Попов  Электрический ток в вакууме
Электрический ток в вакууме Рух тіла під дією кількох сил
Рух тіла під дією кількох сил Проводники с током в магнитном поле. Теорема Гаусса для магнитного поля
Проводники с током в магнитном поле. Теорема Гаусса для магнитного поля Расширение воздуха при нагревании
Расширение воздуха при нагревании Полный факторный эксперимент
Полный факторный эксперимент Газовые законы
Газовые законы Уход за швейной машиной
Уход за швейной машиной Законы Ньютона
Законы Ньютона Воздухоплавание
Воздухоплавание Гидростатическое давление в точке. Тема 1
Гидростатическое давление в точке. Тема 1 Кинематика. Средняя скорость
Кинематика. Средняя скорость Однофазные цепи
Однофазные цепи Experimental methods for studies of ion – molecule reaktions and of ion – electron rekombination
Experimental methods for studies of ion – molecule reaktions and of ion – electron rekombination Квантовая криптография
Квантовая криптография Линзы. Виды линз
Линзы. Виды линз Анализаторы ситовые
Анализаторы ситовые Архитектурно-строительная акустика
Архитектурно-строительная акустика