Содержание
- 2. Обзор
- 3. Растениеводческое освещение Что такое растениеводческое освещение и как оно применяется? Досвечивание Дополняет естественный дневной свет и
- 4. Растениеводческое освещение Как свет влияет на рост растений? Количество света Количество света влияет на процесс фотосинтеза
- 5. Различие в спектрах поглощения для фотохимических реакций в человеческом глазу и в растениях Под воздействием света
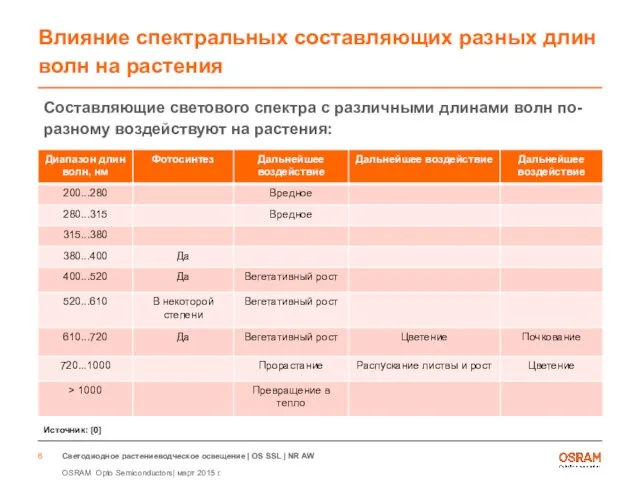
- 6. Составляющие светового спектра с различными длинами волн по-разному воздействуют на растения: Влияние спектральных составляющих разных длин
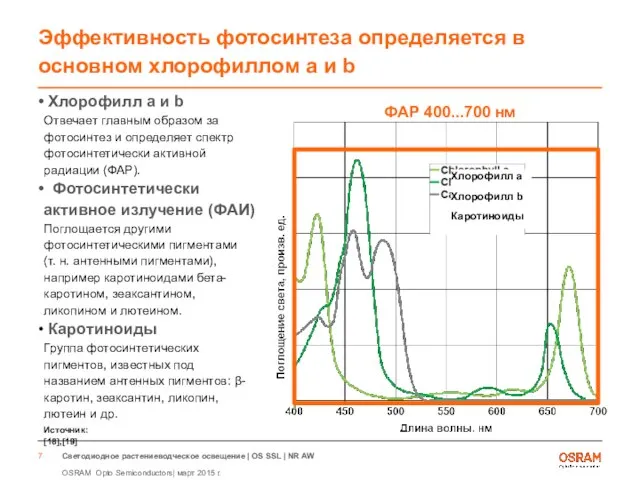
- 7. Эффективность фотосинтеза определяется в основном хлорофиллом a и b Хлорофилл a и b Отвечает главным образом
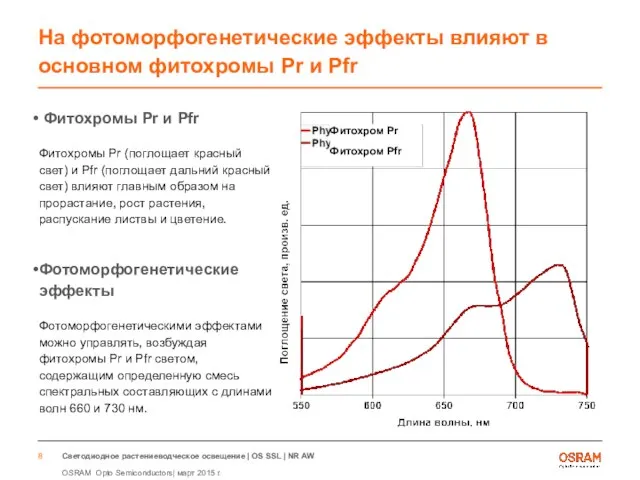
- 8. На фотоморфогенетические эффекты влияют в основном фитохромы Pr и Pfr Фитохромы Pr и Pfr Фитохромы Pr
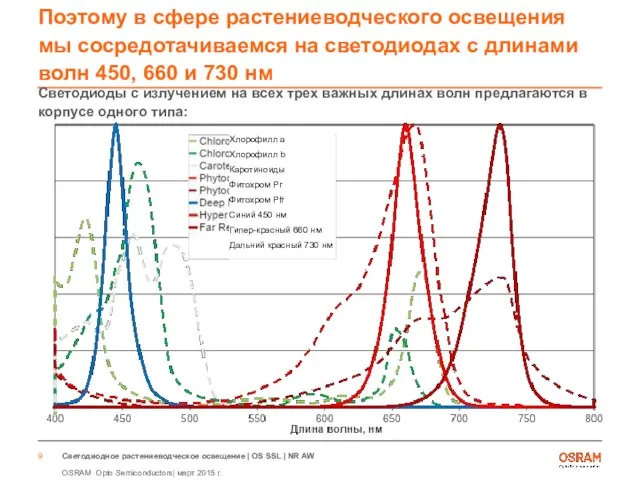
- 9. Поэтому в сфере растениеводческого освещения мы сосредотачиваемся на светодиодах с длинами волн 450, 660 и 730
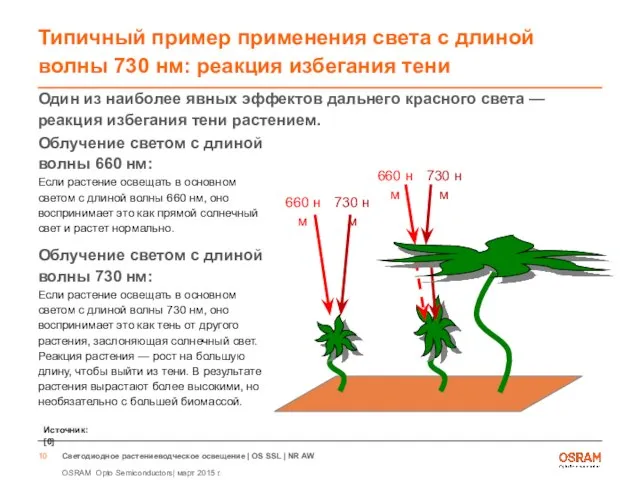
- 10. Типичный пример применения света с длиной волны 730 нм: реакция избегания тени Один из наиболее явных
- 11. Особый потенциал светодиодов в цветоводстве Декоративные растения традиционно имеют большую экономическую значимость. Красный и дальний красный
- 12. Управление цветением путем влияния на критическую продолжительность светового дня с помощью любого света Так как соотношение
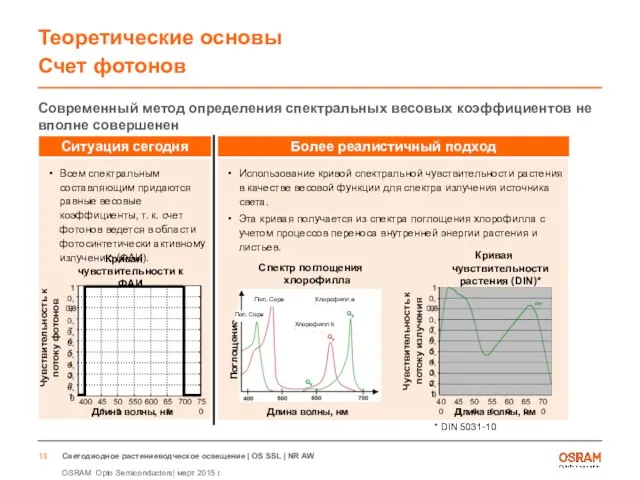
- 13. Теоретические основы Счет фотонов Современный метод определения спектральных весовых коэффициентов не вполне совершенен Всем спектральным составляющим
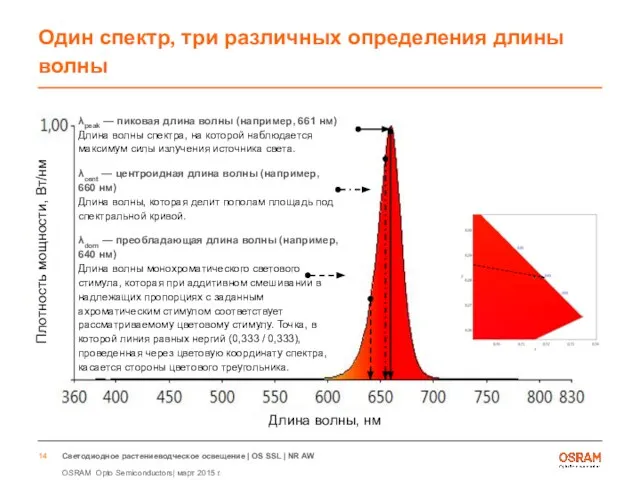
- 14. Один спектр, три различных определения длины волны λpeak — пиковая длина волны (например, 661 нм) Длина
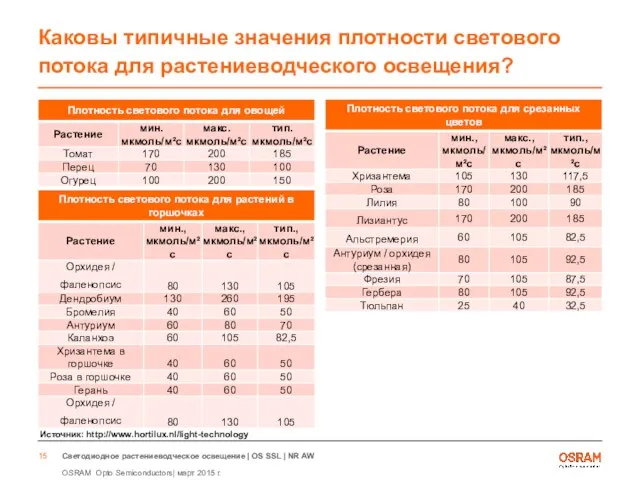
- 15. Каковы типичные значения плотности светового потока для растениеводческого освещения? Источник: http://www.hortilux.nl/light-technology
- 16. Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]
- 17. Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]
- 18. Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]
- 19. Воздействие синего света с длиной волны около 450 нм на физиологию растений Источник: [0]
- 20. Воздействие зеленого света с длиной волны около 520 нм на физиологию растений Источник: [0]
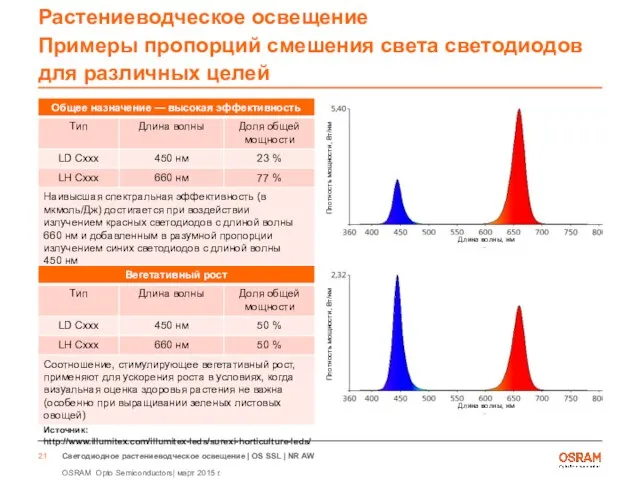
- 21. Растениеводческое освещение Примеры пропорций смешения света светодиодов для различных целей Источник: http://www.illumitex.com/illumitex-leds/surexi-horticulture-leds/ Длина волны, нм Плотность
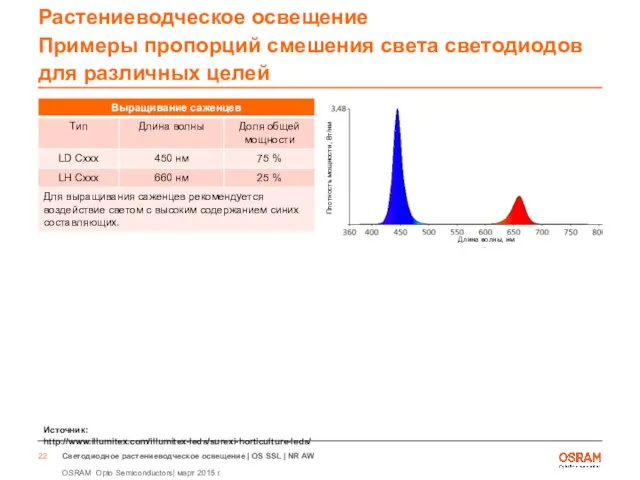
- 22. Растениеводческое освещение Примеры пропорций смешения света светодиодов для различных целей Источник: http://www.illumitex.com/illumitex-leds/surexi-horticulture-leds/ Длина волны, нм Плотность
- 23. Внутриценозное освещение: иллюстрация предоставлена Netled Oy OSLON® SSL Светодиодное тепличное освещение Верхнее освещение Внутриценозное освещение На
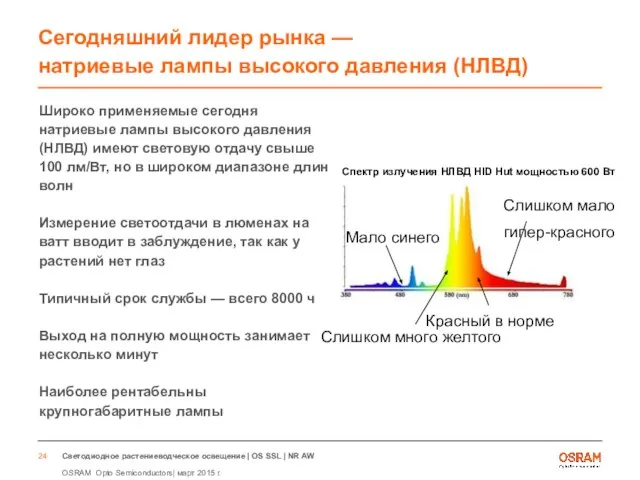
- 24. Сегодняшний лидер рынка — натриевые лампы высокого давления (НЛВД) Широко применяемые сегодня натриевые лампы высокого давления
- 25. Продукты
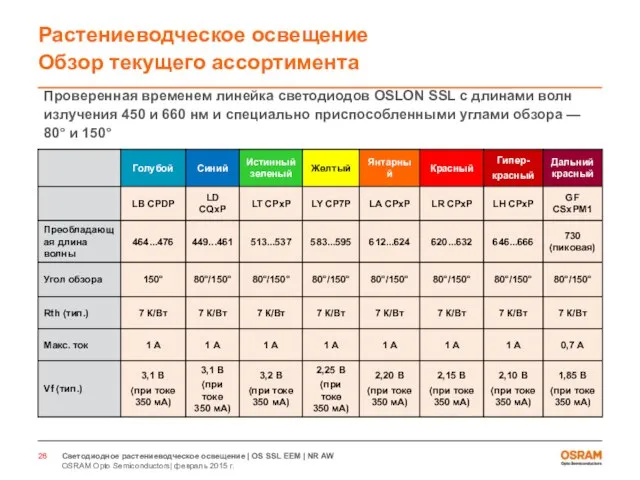
- 26. OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM | NR AW
- 27. OSLON® SSL 451 нм
- 28. LD CQ7P (80°) LD CQDP (150°) Продукт выпущен в продажу Основные особенности λ peak = 451
- 29. OSLON® 660 нм
- 30. LH CP7P (80°) LH CPDP (150°) Продукт выпущен в продажу Основные особенности λpeak = 660 нм
- 31. OSLON SSL 730 нм
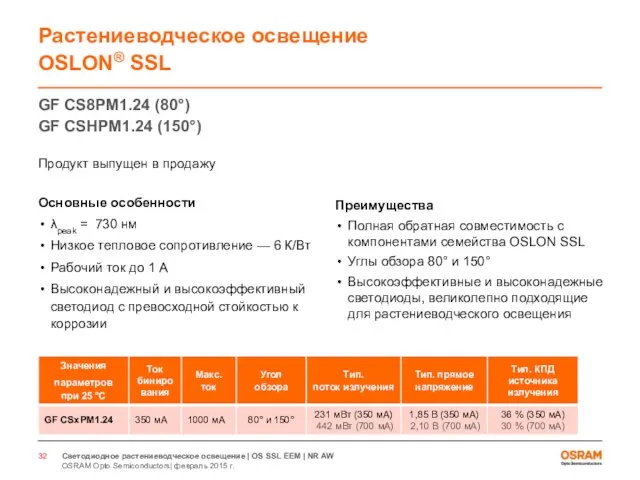
- 32. GF CS8PM1.24 (80°) GF CSHPM1.24 (150°) Продукт выпущен в продажу Основные особенности λpeak = 730 нм
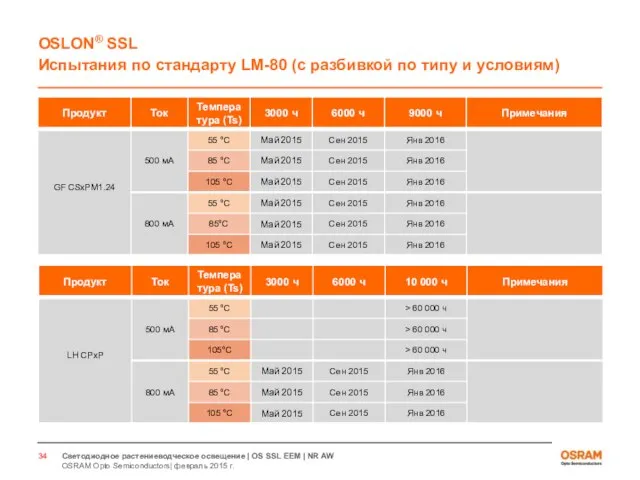
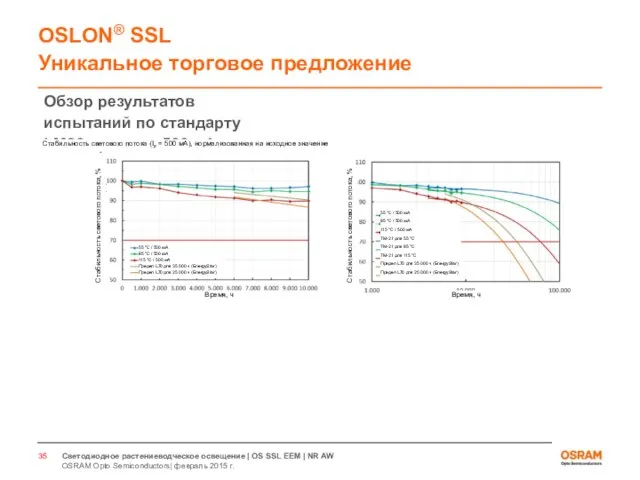
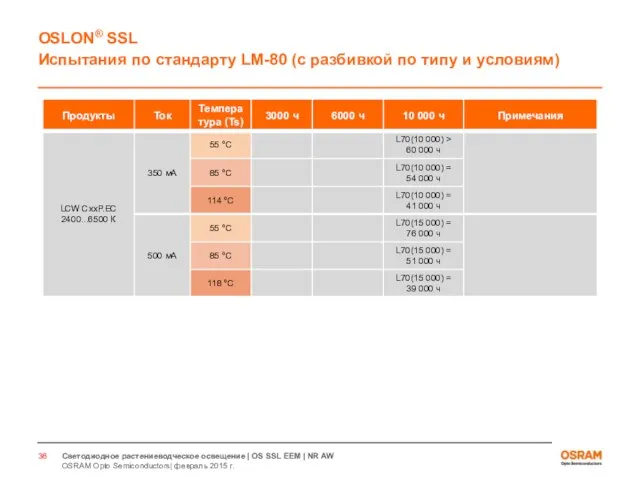
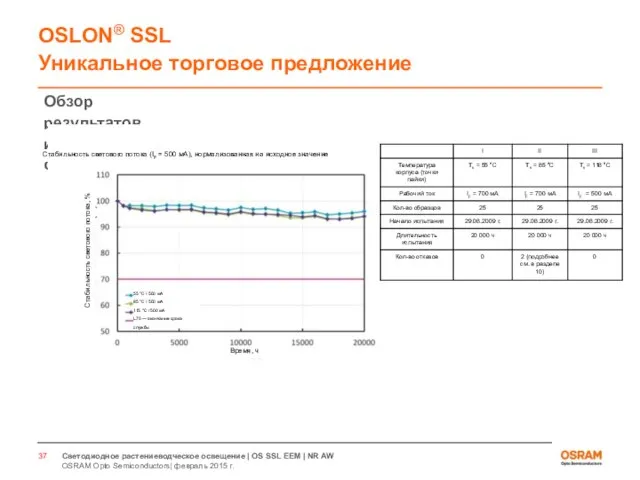
- 33. Светодиоды для растениеводческого освещения Испытания по стандарту LM80
- 34. ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM
- 35. ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM
- 36. ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM
- 37. ДЛЯ ВНУТРЕННЕГО ИСПОЛЬЗОВАНИЯ OSRAM Opto Semiconductors| февраль 2015 г. Светодиодное растениеводческое освещение | OS SSL EEM
- 38. Приложение
- 39. Термины и определения Радиометрия: совокупность методов измерения параметров электромагнитного излучения (ЭМИ) на всем протяжении его спектра.
- 40. Термины и определения Фотосинтез: процесс, посредством которого растения и другие организмы преобразуют свет в химическую энергию,
- 41. Список литературы Список литературы 0. Singh, Devesh, et al. "LEDs for Energy Efficient Greenhouse Lighting." arXiv
- 42. Список литературы 11. Bourget CM. An introduction to light-emitting diodes. Hort Science. 2008;43:1944-1946. 12. Brumfield R.
- 43. Список литературы 22. Tripathy BC & Brown CS. Root-shoot interaction in the greening of wheat seedlings
- 44. Список литературы 32. Li H, Tang C, Xu Z, Liu X & Han X. Effects of
- 45. 41. Bliznikas Z, Žukauskas A, Samuolienė G, Viršilė A, Brazaitytė A, Jankauskienė J, Duchovskis P &
- 46. Список литературы 51.Yanovsky MJ & Kay SA. Molecular basis of seasonal time measurement in Arabidopsis. Nature.
- 48. Скачать презентацию






![Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895802/slide-15.jpg)
![Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895802/slide-16.jpg)
![Воздействие красного света с длиной волны около 660 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895802/slide-17.jpg)
![Воздействие синего света с длиной волны около 450 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895802/slide-18.jpg)
![Воздействие зеленого света с длиной волны около 520 нм на физиологию растений Источник: [0]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/895802/slide-19.jpg)

















 Молекулярная физика
Молекулярная физика Плотность. Решение задач
Плотность. Решение задач Теплоносители и их свойства. Реальные газы. Уравнения состояний. Тройная точка воды. (Тема 5)
Теплоносители и их свойства. Реальные газы. Уравнения состояний. Тройная точка воды. (Тема 5) Расчет цепей с несколькими источниками ЭДС методом наложения
Расчет цепей с несколькими источниками ЭДС методом наложения Магнитное поле
Магнитное поле Электростатическое поле в диэлектрике. Лекция 3-2020
Электростатическое поле в диэлектрике. Лекция 3-2020 Вес тела
Вес тела Цвет. Тест
Цвет. Тест Смесительный бак с регулированием уровня и температуры. Пример
Смесительный бак с регулированием уровня и температуры. Пример Виды движения
Виды движения Электродинамика. Электростатика
Электродинамика. Электростатика Векторы электрического поля
Векторы электрического поля Презентация на тему Влияние электромагнитного поля на организм человека
Презентация на тему Влияние электромагнитного поля на организм человека  Решение задач по теме Закон Кулона. 10 класс
Решение задач по теме Закон Кулона. 10 класс Основные понятия статики. Лекция 1
Основные понятия статики. Лекция 1 Электрическое освещение бытовых и промышленных объектов
Электрическое освещение бытовых и промышленных объектов Источники света. Прямолинейное распространение света
Источники света. Прямолинейное распространение света Основное уравнение МКТ. Связь кинетичекой энергии с температурой
Основное уравнение МКТ. Связь кинетичекой энергии с температурой 11, задание и конспект по электростатике
11, задание и конспект по электростатике Опыты с водой (для дошкольников)
Опыты с водой (для дошкольников) Способы соединения частей: шестеренки
Способы соединения частей: шестеренки Виды подшипников
Виды подшипников Сила. Явление тяготения. Сила тяжести. Примеры взаимодействия тел
Сила. Явление тяготения. Сила тяжести. Примеры взаимодействия тел Электрический ток
Электрический ток Электричество и магнетизм
Электричество и магнетизм Электроматериаловедение. Электротехнические материалы
Электроматериаловедение. Электротехнические материалы Масса тела. Единицы массы. Измерение массы на весах
Масса тела. Единицы массы. Измерение массы на весах Основные характеристики гребных винтов
Основные характеристики гребных винтов