Содержание
- 2. Из переходного состояния TS система без всякого поглощения энергии может перейти либо в продукт, либо в
- 3. Энтальпия активации - разность энтальпий образования TS и исходного состояния. Различия в характеризуют изменения энергии системы
- 4. Для неполярных реакций (между электронейтральными молекулами, когда образуются незаряженные продукты) эффекты сольватации не могут играть значительной
- 5. При возникновении в ходе реакции зарядов переходное состояние обладает более высоким дипольным моментом, чем исходная система.
- 6. Термодинамический и кинетический контроль состава продуктов Очень часто наблюдается ситуация когда из одних и тех же
- 7. Несовпадение кинетического и термодинамического контроля при образовании продуктов может наблюдаться для обратимых реакций. Например, Энергетический профиль
- 8. 1) скорость образования первого и второго продуктов реакции из исходных соединений значительно выше, чем скорость достижения
- 9. Например при присоединении бромистого водорода к бутадиену первоначально образуется смесь, содержащая преимущественно 3-бромбутен-1 (1) (1 –
- 11. Скачать презентацию
Слайд 2 Из переходного состояния TS система без всякого поглощения энергии может перейти
Из переходного состояния TS система без всякого поглощения энергии может перейти

Основное положение теории переходного состояния заключается в том, что TS находится в равновесии с исходными соединениями, и это позволяет вывести уравнение константы скорости реакции (уравнение Аррениуса):
– константа скорости;
– предэкспоненциальный множитель;
– универсальная газовая постоянная;
– абсолютная температура, К.
– изменение энергии Гиббса при переходе от реагентов к TS.
Слайд 3 Энтальпия активации - разность энтальпий образования TS и исходного состояния. Различия
Энтальпия активации - разность энтальпий образования TS и исходного состояния. Различия

Кроме того, включает различия в сольватации, а также в кулоновской энергии при возникновении/исчезновении зарядов.
Энтропия активации описывает разность в степени упорядоченности исходной системы и переходного состояния. Ее находят как разность между значениями энтропий переходного состояния и исходных соединений. Эта разность существенно зависит от ограниченности поступательного и вращательного движений переходного состояния и исходных соединений, а также может определятся различиями в сольватации этих частиц. Если переходное состояние более компактное, чем исходная система (число степеней свободы уменьшается), то в этом случае имеет отрицательное значение. Напротив, при более свободном расположении атомов в переходном состоянии (число степеней свободы увеличивается) ее значение будет положительным. Таким образом, сведения о переходном состоянии реак-ции можно получить как из знака, так и из абсолютного значения .
Слайд 4 Для неполярных реакций (между электронейтральными молекулами, когда образуются незаряженные продукты) эффекты
Для неполярных реакций (между электронейтральными молекулами, когда образуются незаряженные продукты) эффекты

Во многих случаях определенное значение энтропии активации является типичным для конкретного механизма реакции. Например, при бимолекулярной реакции две молекулы со свободным поступательным движением объединяются в переходном состоянии в единое целое. В следствии этого общая энтропия уменьшается. Значение в бимолекулярных реакциях примерно равно -20 кал/(моль·К). Для реакций циклоприсоединения имеет еще более отрицательное значение.
Если же степень свободы движения отдельных групп атомов при достижении переходного состояния увеличивается, то значение энтропии активации становится положительным. Такое наблюдается для радикальных реакций и реакций, в которых стадией, определяющей скорость превращения, является стадия диссоциации субстрата.
Слайд 5 При возникновении в ходе реакции зарядов переходное состояние обладает более высоким
При возникновении в ходе реакции зарядов переходное состояние обладает более высоким

Стерические взаимодействия в переходном состоянии также сказываются на величине . Для реакций SN2 в TS у реакционного центра находятся 5 заместителей, причем в исходном веществе их 4. В результате этого в пентакоординированном TS происходит ограничение их движения по сравнению с исходным состоянием. Энтальпия активации при этом снижается. Причем это снижение становится более заметным при переходе к более объемным заместителям.
Для полярных реакций возникновение и исчезновение зарядов вносит заметные изменения в энтропию реакции. В случае, когда исходная система малополярна, окружающие молекулы растворителя практически неограниченны в своем движении.
QChem
Слайд 6Термодинамический и кинетический контроль состава продуктов
Очень часто наблюдается ситуация когда из
Термодинамический и кинетический контроль состава продуктов
Очень часто наблюдается ситуация когда из

Нередко при изучении кинетики таких процессов о соотношении скоростей судят по относительным количествам образующихся продуктов, полагая при этом, что соотношение продуктов определяется соотношением скоростей и, следовательно, разностью значений энергии активации образования соответствующих продуктов.
Если реакции протекают необратимо и продукты реакции стабильны, то их соотношение определяется разностью энергий Гиббса переходных состояний. При этом говорят, что соотношение продуктов подчиняется кинетическому контролю.
Кинетический контроль характерен для всех необратимых реакций.
Слайд 7 Несовпадение кинетического и термодинамического контроля при образовании продуктов может наблюдаться для
Несовпадение кинетического и термодинамического контроля при образовании продуктов может наблюдаться для
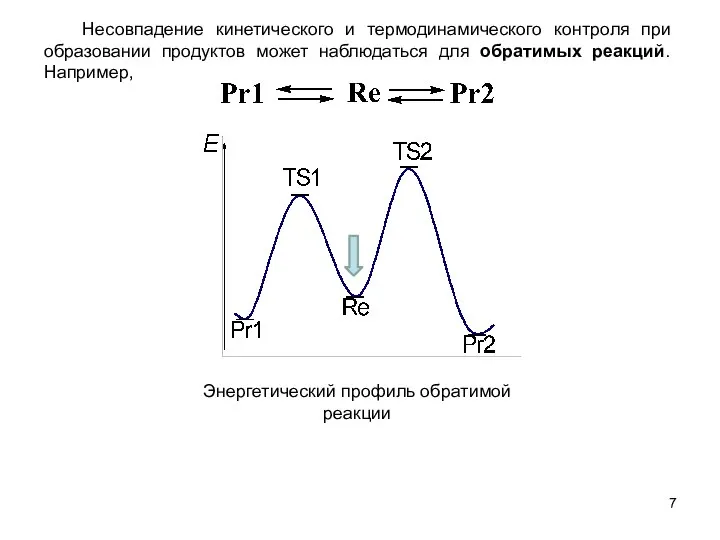
Энергетический профиль обратимой реакции
Слайд 8 1) скорость образования первого и второго продуктов реакции из исходных соединений
1) скорость образования первого и второго продуктов реакции из исходных соединений

2) скорость достижения равновесия соизмерима со скоростью превращения исходных соединений и через некоторое время соотношение продуктов будет определятся разностью энергий Гиббса продуктов реакции, т. е. их термодинамической устойчивостью. Такая реакция идет при термодинамическом контроле.
3) если скорость установления равновесия между продуктами меньше, чем скорость реакции Re → Pr1, то первоначальное соотношение продуктов будет подчинятся кинетическому контролю, а затем система придет к состоянию термодинамического равновесия.
Для обратимых реакций типичны 3 случая:
Слайд 9 Например при присоединении бромистого водорода к бутадиену первоначально образуется смесь, содержащая
Например при присоединении бромистого водорода к бутадиену первоначально образуется смесь, содержащая

Однако этот продукт термодинамически менее устойчив, чем
1-бромбутен-2 (2). Если вести реакцию при более высокой температуре и большей продолжительности взаимодействия, то устанавливается равновесие и происходит увеличение количества термодинамически более устойчивого соединения 2 (1 – 20%, 2 – 80%,).
Таким образом, при увеличении температуры наблюдается переход от кинетического контроля процесса к термодинамическому.
 Глубокая яма
Глубокая яма Критерии прочности при изгибе. Распространение критериев прочности на случай циклического нагружения
Критерии прочности при изгибе. Распространение критериев прочности на случай циклического нагружения Трение в живой природе
Трение в живой природе Сила трения. Трение скольжения. Трение покоя. (7 класс)
Сила трения. Трение скольжения. Трение покоя. (7 класс) Спектры. Наблюдение сплошного и линейчатого спектров излучения ионизированных газов
Спектры. Наблюдение сплошного и линейчатого спектров излучения ионизированных газов Работа, мощность и энергия. Задачи
Работа, мощность и энергия. Задачи Равноускоренное прямолинейное движение
Равноускоренное прямолинейное движение Рамка с током в магнитном поле
Рамка с током в магнитном поле Организация проектно-исследовательской деятельности с учащимися по физике
Организация проектно-исследовательской деятельности с учащимися по физике Альтернативные источники энергии
Альтернативные источники энергии УФ-спектроскопия. Практическое занятие 2
УФ-спектроскопия. Практическое занятие 2 Лекция 9. Выпаривание
Лекция 9. Выпаривание Нелинейно-оптические методы измерений в фемтосекундной оптике
Нелинейно-оптические методы измерений в фемтосекундной оптике Презентация на тему Физика в спорте
Презентация на тему Физика в спорте  Презентация на тему Вычисление массы и объема тела 7 класс
Презентация на тему Вычисление массы и объема тела 7 класс  Презентация на тему Изобретение радио А.С. Поповым
Презентация на тему Изобретение радио А.С. Поповым  Простые механизмы. КПД
Простые механизмы. КПД Электростатика. Электрические взаимодействия
Электростатика. Электрические взаимодействия Напряжение. Конспект урока. 8 класс
Напряжение. Конспект урока. 8 класс Коллективные спасательные средства. Тема 2.3
Коллективные спасательные средства. Тема 2.3 Дисперсия света
Дисперсия света Прикладная механика. Тема 1: Кинематика точки
Прикладная механика. Тема 1: Кинематика точки Физика как наука. Методы познания
Физика как наука. Методы познания Зубчатые колеса
Зубчатые колеса Классная физика. Квест-игра
Классная физика. Квест-игра Преобразования сигналов и Вейвлет-преобразование
Преобразования сигналов и Вейвлет-преобразование Особенности распространения и восприятия света
Особенности распространения и восприятия света Тест по теме «Механическое движение» 7 класс
Тест по теме «Механическое движение» 7 класс