Содержание
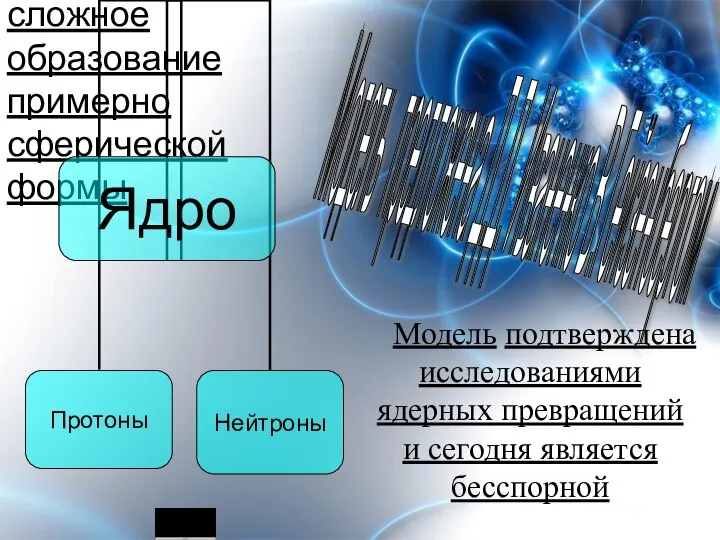
- 2. Ядро атома – сложное образование примерно сферической формы Модель предложена Д.Д. Иваненко В.Гейзенбергом Модель подтверждена исследованиями
- 3. Протон – положительно заряженная частица, ядро атома водорода (по греч. протос - первый) 1919 г. –
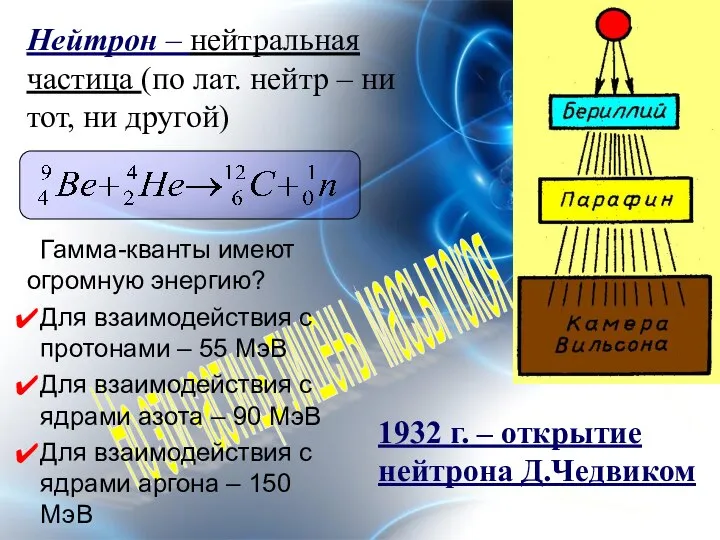
- 4. Но эти частицы лишены массы покоя 1932 г. – открытие нейтрона Д.Чедвиком Гамма-кванты имеют огромную энергию?
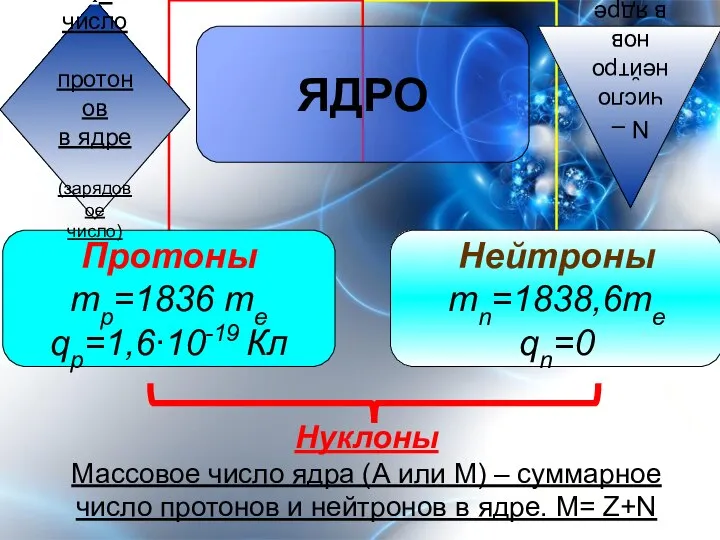
- 5. Нуклоны Массовое число ядра (А или М) – суммарное число протонов и нейтронов в ядре. М=
- 6. Нуклоны непрерывно движутся внутри ядра, обмениваясь пи-мезонами, а само ядро совершает медленное вращательное движение. Нуклоны обладают
- 7. Что сегодня знают о нуклонах? Размеры ядер тем больше, чем больше в них нуклонов Плотность нуклонов
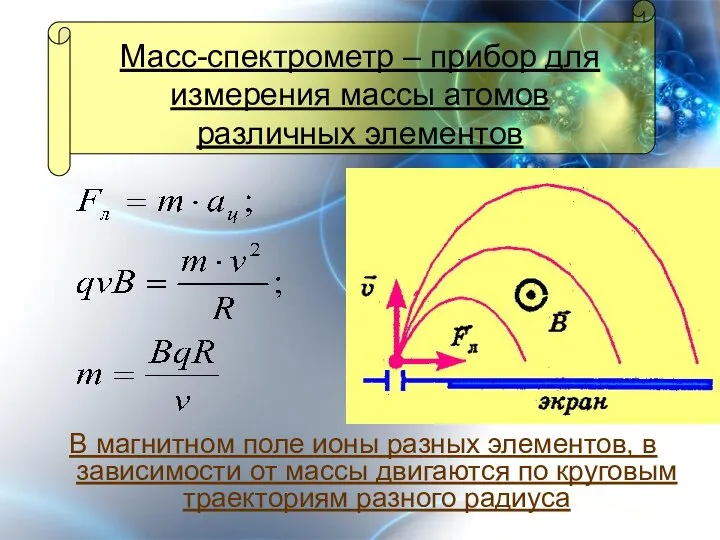
- 8. Масс-спектрометр – прибор для измерения массы атомов различных элементов В магнитном поле ионы разных элементов, в
- 9. Величины, характеризующие ядро Диаметр ядра измеряют в фемтометрах 1фм=10-15 м Для легких ядер – 1фм, тяжелых
- 10. Энергия ядер элементов дискретна, т.е. квантуется Нулевой уровень соответствует основному (невозбужденному) состоянию, остальные – возбужденным состояниям
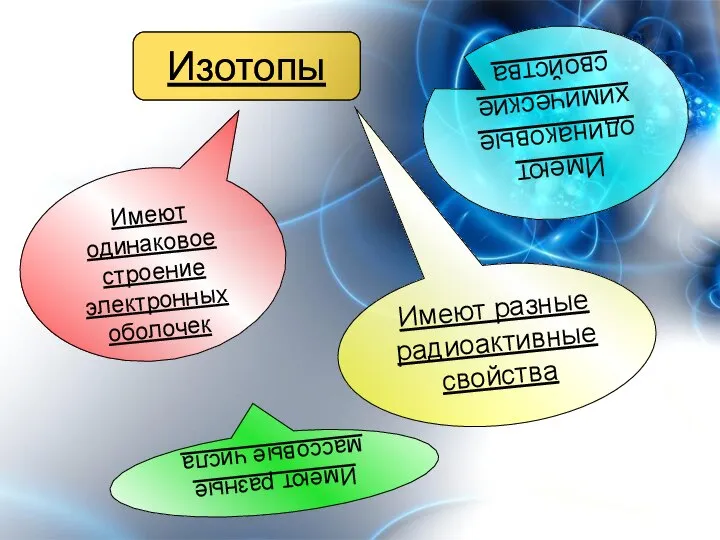
- 11. Изотопы – разновидности атомов одного и того же химического элемента, имеющие одинаковое число протонов в ядрах
- 12. Изотопы Имеют одинаковое строение электронных оболочек Имеют одинаковые химические свойства Имеют разные радиоактивные свойства Имеют разные
- 13. В настоящее время известно 276 стабильных изотопов, принадлежащих 83 элементам, и более 2000 радиоактивных Химически чистые
- 15. Скачать презентацию







 Презентация на тему Открытие нейтрона. Строение атомного ядра
Презентация на тему Открытие нейтрона. Строение атомного ядра  Кинематика точки
Кинематика точки Презентация на тему Создания вечного двигателя
Презентация на тему Создания вечного двигателя  Волновые явления. Занимательная физика. 4 класс
Волновые явления. Занимательная физика. 4 класс Волокна большого диаметра. Анализ фазового состава, макро- и микроструктуры полуфабрикатов и готовых изделий из B-Al
Волокна большого диаметра. Анализ фазового состава, макро- и микроструктуры полуфабрикатов и готовых изделий из B-Al Биополярные СВЧ-транзисторы
Биополярные СВЧ-транзисторы Обработка спектров
Обработка спектров Испарение. Насыщенный и ненасыщенный пар
Испарение. Насыщенный и ненасыщенный пар Композиционные материалы на наноуровне
Композиционные материалы на наноуровне Графики в задачах по кинематике
Графики в задачах по кинематике Опыт Резерфорда по рассеянию альфа-частиц. Постулаты Бора. Опыты Франка и Герца. Понятие о нелинейной оптике. Лазеры. Волновые
Опыт Резерфорда по рассеянию альфа-частиц. Постулаты Бора. Опыты Франка и Герца. Понятие о нелинейной оптике. Лазеры. Волновые Светодиодный светильник
Светодиодный светильник Физические методы анализа
Физические методы анализа Постоянные магниты
Постоянные магниты Презентация на тему Законы геометрической оптики
Презентация на тему Законы геометрической оптики  Исследование параметров и характеристик полупроводниковых диодов. Лабораторная работа
Исследование параметров и характеристик полупроводниковых диодов. Лабораторная работа Электрический заряд, электризация
Электрический заряд, электризация Звук. Характеристики звука
Звук. Характеристики звука Датчик исследований динамики углекислого газа в лес
Датчик исследований динамики углекислого газа в лес Прижимы: схемы и расчет
Прижимы: схемы и расчет Рентгеновские лучи
Рентгеновские лучи Технологии беспроводной передачи энергии методом электромагнитной индукции
Технологии беспроводной передачи энергии методом электромагнитной индукции Наночастицы, нанопорошки, эмульсии
Наночастицы, нанопорошки, эмульсии Показатели регулирования САУ
Показатели регулирования САУ Презентация по физике "Кто и как управляет электрическим током" -
Презентация по физике "Кто и как управляет электрическим током" -  Простые механизмы
Простые механизмы Силы в природе
Силы в природе Измерительные приборы
Измерительные приборы