Содержание
- 3. 2. Электронное строение 3. Свойства атома 4. Строение простого вещества 5. Физические свойства 6. Химические свойства
- 4. 1. Из истории открытия Далее Впервые Al был получен датским физиком Эрстедом в 1825 г. Название
- 5. 1. Из истории открытия В период открытия алюминия этот металл был дороже золота. Англичане хотели почтить
- 6. 2. Электронное строение 27 Аl +13 0 2e 8e 3e 1s2 2s2 2p6 3s2 3p1 Краткая
- 7. Вставьте пропущенные слова Алюминий - элемент III группы, главной подгруппы. Заряд ядра атома алюминия равен +13.
- 8. Главная
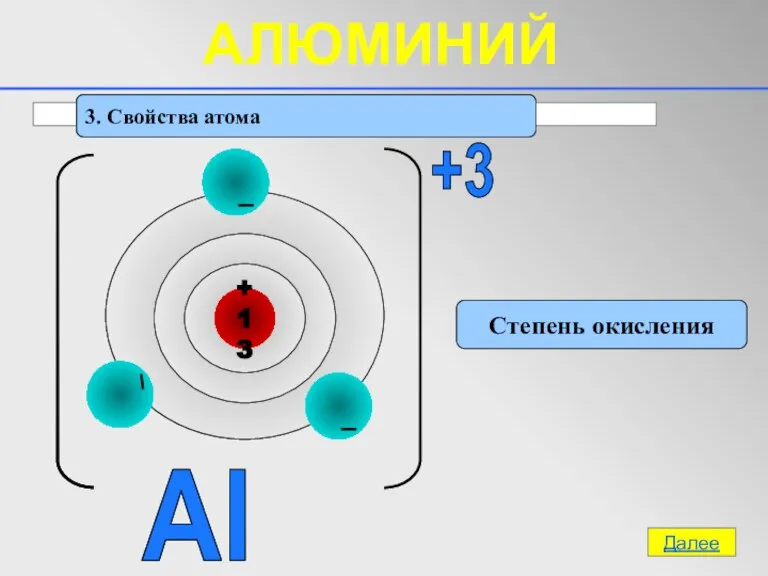
- 9. 3. Свойства атома Степень окисления Al +3 Далее АЛЮМИНИЙ
- 10. 3. Свойства атома Восстановительные Электрохимический ряд напряжений металлов Li, K, Ca, Na, Mg, Al, Cr, Zn,
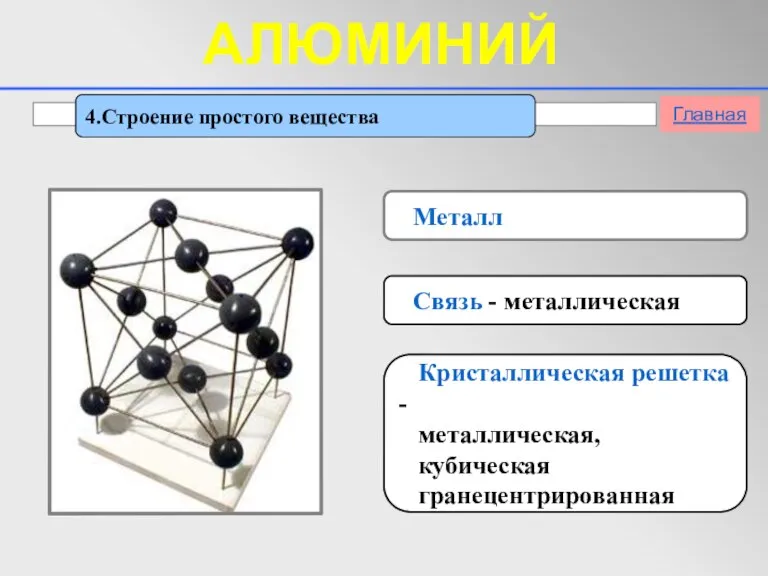
- 11. 4.Строение простого вещества Металл Связь - металлическая Кристаллическая решетка - металлическая, кубическая гранецентрированная Главная АЛЮМИНИЙ
- 12. 5. Физические свойства Главная АЛЮМИНИЙ
- 13. 6. Химические свойства 4Аl + 3O2 = 2Al2O3 t 2Al + 3S = Al2S3 C н
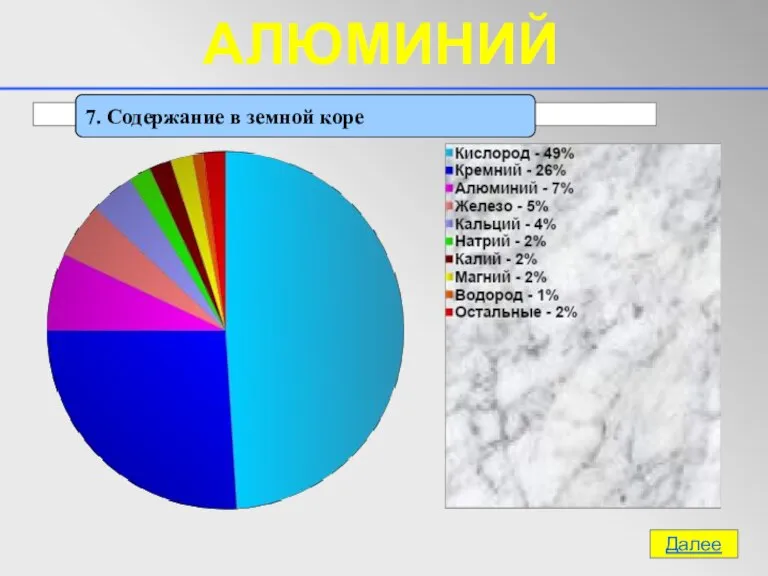
- 14. 7. Содержание в земной коре Далее АЛЮМИНИЙ
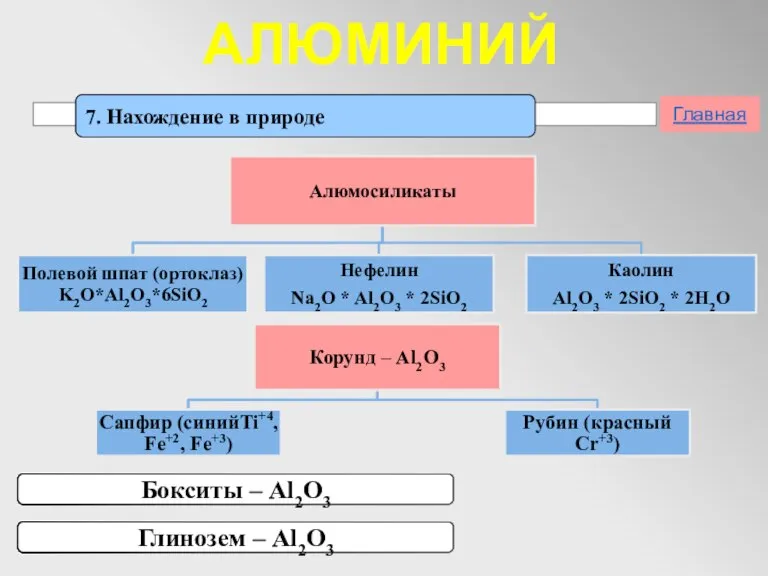
- 15. АЛЮМИНИЙ 7. Нахождение в природе Главная Бокситы – Al2O3 Глинозем – Al2O3
- 16. 8. Получение Главная АЛЮМИНИЙ
- 17. 9. Применение Далее АЛЮМИНИЙ
- 19. Скачать презентацию











 Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ
Скорость химической реакции и химическое равновесие. Задание 20 в ЕГЭ Spectroscopy. U.V. Lect.2
Spectroscopy. U.V. Lect.2 Тосол. Гликолевые антифризы
Тосол. Гликолевые антифризы Молекулы и атомы. Относительная атомная масса
Молекулы и атомы. Относительная атомная масса Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна
Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна Презентация на тему Неорганические и органические основания
Презентация на тему Неорганические и органические основания  Основания. 8 класс
Основания. 8 класс Камень, скользящий на льду
Камень, скользящий на льду 12_BROMATOMETRIYa_NITRITOMETRIYa
12_BROMATOMETRIYa_NITRITOMETRIYa Электролиз
Электролиз Углеводороды. Алкены, этилен
Углеводороды. Алкены, этилен Цветные опыты
Цветные опыты Презентация на тему Серная кислота
Презентация на тему Серная кислота  Химическая связь. Метод валентных связей
Химическая связь. Метод валентных связей Расчет физических свойств нефтепродуктов. Практическая работа 1
Расчет физических свойств нефтепродуктов. Практическая работа 1 Вода. Растворы
Вода. Растворы Примеры контекстных задач в 9 классе
Примеры контекстных задач в 9 классе Промышленный биокатализ
Промышленный биокатализ Охрана родников Ногликского района и анализ воды из этих родников
Охрана родников Ногликского района и анализ воды из этих родников Презентация на тему Нефть. Переработка нефти
Презентация на тему Нефть. Переработка нефти  Моделирование состава биоплёночного материала
Моделирование состава биоплёночного материала Органическая химия
Органическая химия Природные источники углеводородов. Нефть. Нахождение в природе,состав и физические свойства
Природные источники углеводородов. Нефть. Нахождение в природе,состав и физические свойства Замедленное коксование нефтяного сырья
Замедленное коксование нефтяного сырья Соли Na2SO4
Соли Na2SO4 Химик белемнәрне тормышта куллану
Химик белемнәрне тормышта куллану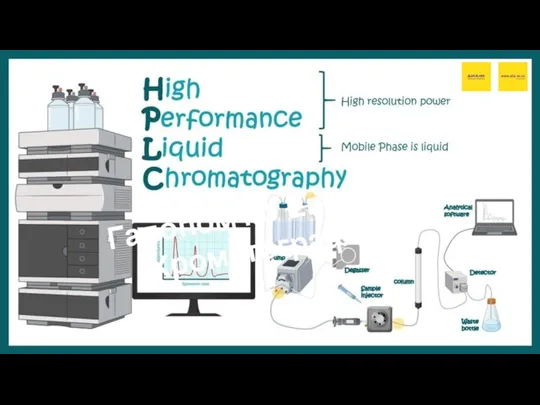 Хроматография
Хроматография Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)