Содержание
- 2. Основаниями называются сложные неорганические соединения состоящие из атома металла и одной или нескольких гидроксильных групп ОН
- 3. Основания Растворимые в воде -ЩЕЛОЧИ NaOH Ba(OH) 2 Нерастворимые Fe(OH) 3 Cu(OH) 2
- 4. Задание: Выпишите формулы оснований К2О, НСl, СuSО4, МgСl2, NaOH Аl203, SO2, НN3, Сu(ОН)2, МgО, SО3, ZnSО4,
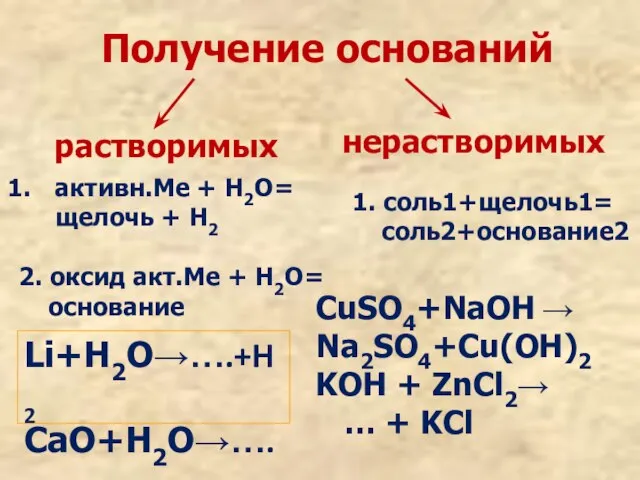
- 5. Получение оснований растворимых нерастворимых активн.Ме + Н2О= щелочь + Н2 2. оксид акт.Ме + Н2О= основание
- 6. Осуществите превращения Na→Na2O→NaOH Cu→CuO→CuCl2→Cu(OH)2
- 7. Решите задачу (р/т с. 94 №5) ω (Mn)= 61,8% ω(O)= 36% ω (H)=2,3% Пусть масса образца
- 8. Вычислите массу гидроксида кальция, который образовался при взаимодействии 11,2г оксида кальция с водой. CaO+H2O=Ca(OH)2
- 9. Химические свойства оснований
- 10. Щёлочи 1.Щёлочи изменяют окраску индикаторов: Лакмус - синий Метилоранж - жёлтый Фенолфталеин - малиновый
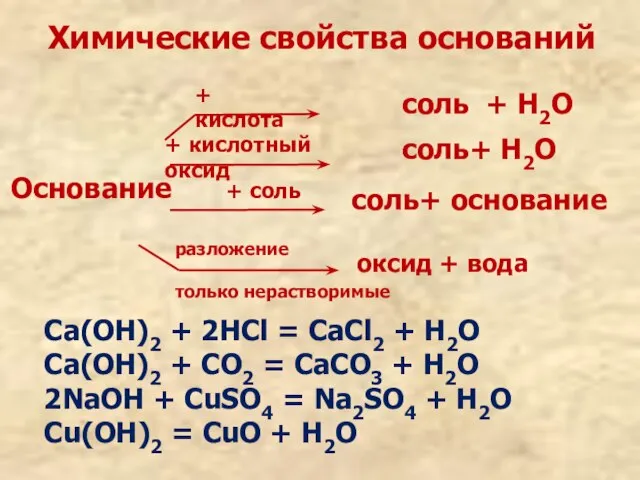
- 11. Химические свойства оснований Основание + кислота соль + Н2О + кислотный оксид соль+ Н2О + соль
- 12. 2.Реакция нейтрализации 2NaOH+H2SO4=Na2SO4+2H2O Основание + кислота = соль + вода ! Осторожно ! Едкие вещества !
- 13. 3. с оксидами неметаллов Ca(OH)2+CO2=CaCO3+H2O 4. с солями Ba(OH)2+CuSO4=Cu(OH)2+BaSO4 Щёлочи разъедают кожу, ткани, бумагу. Осторожно! Смыть
- 15. Скачать презентацию










 Замедленное коксование гудрона
Замедленное коксование гудрона Органическая химия
Органическая химия Соль - без вины виновата
Соль - без вины виновата Этапы приготовления и микроскопического исследования нативного препарата осадка мочи
Этапы приготовления и микроскопического исследования нативного препарата осадка мочи Электролитическая диссоциация
Электролитическая диссоциация Ko pēta ķīmija
Ko pēta ķīmija Химики на службе у дорог
Химики на службе у дорог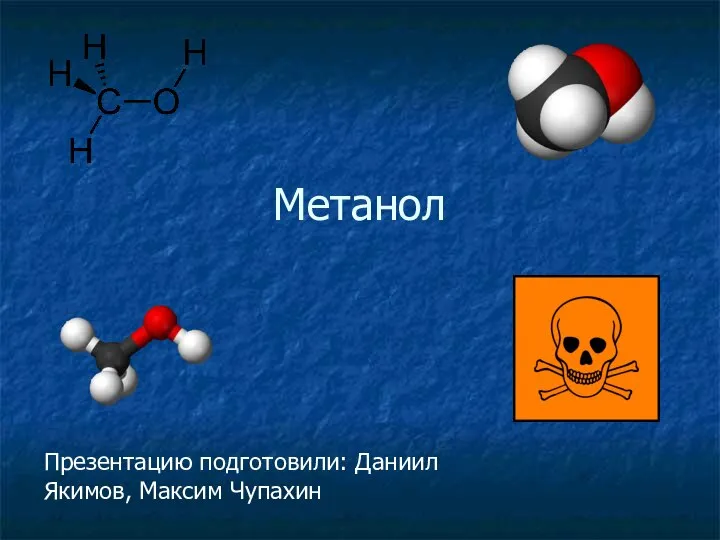 Метанол. Краткая характеристика
Метанол. Краткая характеристика Презентация на тему Электролиз расплавов и растворов
Презентация на тему Электролиз расплавов и растворов  Кислоты органические и неорганически
Кислоты органические и неорганически Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР
Единый государственный экзамен по ХИМИИ (консультация 3) О.П. Костенко, проректор ГОУ РК «ИПК РО» по НМР Полимеризация бутилена и пропилена
Полимеризация бутилена и пропилена Тестовые задания. Атомы
Тестовые задания. Атомы Турнир знатоков химии
Турнир знатоков химии Игра Что? Где? Когда?. Химия
Игра Что? Где? Когда?. Химия Пероксид щелочных металлов
Пероксид щелочных металлов Актуальные вопросы биохимии спорта. Лекция 2
Актуальные вопросы биохимии спорта. Лекция 2 Алканы – строение, химические свойства
Алканы – строение, химические свойства Полупроводники. Химические свойства полупроводников
Полупроводники. Химические свойства полупроводников Атомның электрондық құрылысы
Атомның электрондық құрылысы Кинетика химических реакций и химическое равновесие. Лекция №4
Кинетика химических реакций и химическое равновесие. Лекция №4 Презентация на тему Актуальные проблемы газовой отрасли России
Презентация на тему Актуальные проблемы газовой отрасли России  Реакции неполного окисления в органике
Реакции неполного окисления в органике Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Реакции разложения
Реакции разложения Алкины
Алкины Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Скорость химической реакции. Факторы, влияющие на скорость
Скорость химической реакции. Факторы, влияющие на скорость