Содержание
- 2. Раствор - это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
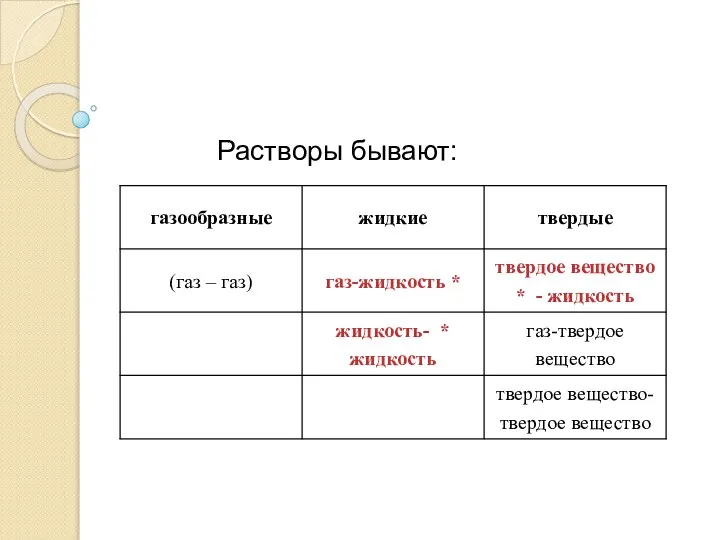
- 4. Растворы бывают:
- 5. Параметры состояния раствора - температура, давление и концентрация.
- 6. Процесс растворения состоит из: 1) фазового перехода (например, кристалл-жидкость) и 2) процесса сольватации Тогда: ΔН =
- 7. Если ΔН = 0 и ΔV = 0, такой раствор называется идеальным. Например, две жидкости, молекулы
- 8. Растворимость газов в жидкостях. ΔНф.п = 0. Следовательно ΔН
- 9. В разбавленных растворах ΔН≈0 и ΔV≈0 . Они приближаются к идеальным растворам. Частицы растворенного вещества далеко
- 10. 1.Массовая доля Отношение массы растворенного вещества к массе раствора, %
- 11. 2. Молярная концентрация Отношение количества растворенного вещества к объему раствора, моль/л
- 12. Отношение массы растворенного вещества к эквивалентной массе растворенного вещества и объему раствора, моль/л 3. Эквивалентная концентрация
- 13. Отношение количества растворенного вещества к массе растворителя, моль/кг 4. Моляльная концентрация или моляльность
- 15. Скачать презентацию











 Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Растворы. Лекция №4
Растворы. Лекция №4 Общие свойства неметаллов
Общие свойства неметаллов Ориентация полимеров
Ориентация полимеров Экстракция молибдат-ионов в расслаивающейся системе антипирин – сульфосалициловая кислота – вода
Экстракция молибдат-ионов в расслаивающейся системе антипирин – сульфосалициловая кислота – вода Металлы
Металлы Понятие об адсорбционной влаге
Понятие об адсорбционной влаге Prezentatsia_k_uroku
Prezentatsia_k_uroku Гидроксиды металлов
Гидроксиды металлов Экономическое значение инвазионных болезней в агропромышленном комплексе. Химиопрофилактика инвазионных болезней
Экономическое значение инвазионных болезней в агропромышленном комплексе. Химиопрофилактика инвазионных болезней Экологическая химия
Экологическая химия Бензол
Бензол Замедленное коксование гудрона
Замедленное коксование гудрона Производные углеводородов
Производные углеводородов Glin
Glin Посвящение в химики
Посвящение в химики Химические вещества, используемые при пайке
Химические вещества, используемые при пайке Электролиз и его применение
Электролиз и его применение Амины
Амины Сталь. Свойства стали
Сталь. Свойства стали Алифатические соединения. Тема № 6
Алифатические соединения. Тема № 6 Железо
Железо MPKh_PREZENTATsIYa_2
MPKh_PREZENTATsIYa_2 Дисперсные системы
Дисперсные системы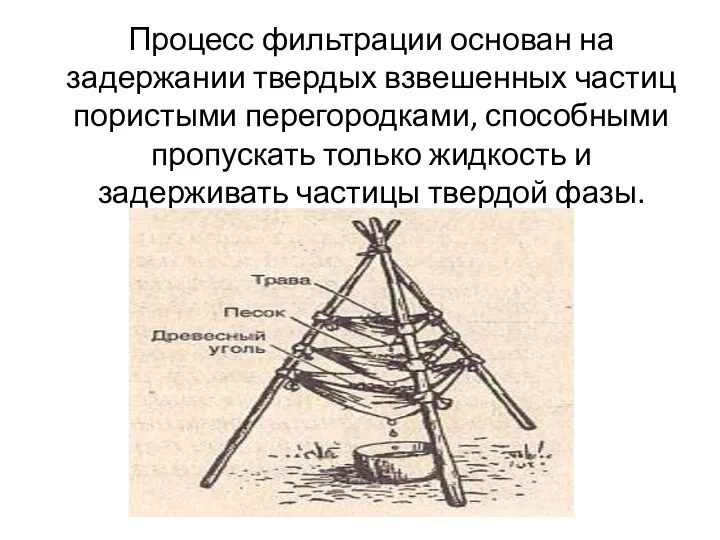 Процесс фильтрации - задержание твердых взвешенных частиц
Процесс фильтрации - задержание твердых взвешенных частиц Металлы. Группы металлов
Металлы. Группы металлов Решение расчетных задач по уравнениям реакций
Решение расчетных задач по уравнениям реакций Основные классы неорганических соединений. Лекция №3
Основные классы неорганических соединений. Лекция №3