Содержание
- 2. Почему протекают химические реакции На бумаге можно написать уравнение любой химической реакции («бумага все стерпит»), а
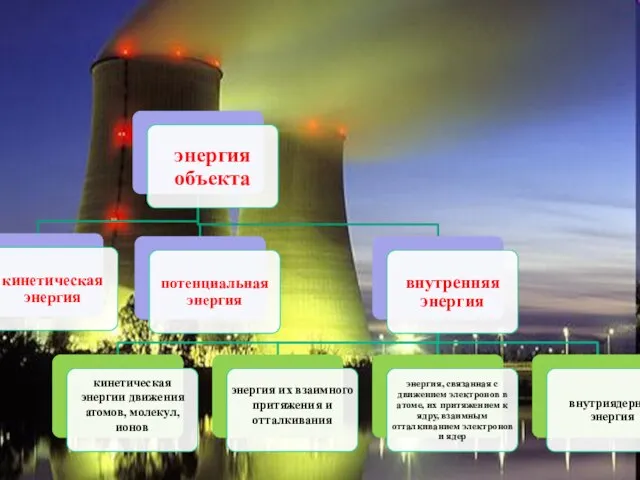
- 3. Термодинамика - наука о взаимных превращениях различных видов энергии. Первый закон термодинамики — закон сохранения энергии:
- 5. Известно, что при химических реакциях происходят глубокие качественные изменения в системе, рвутся связи в исходных веществах
- 6. Тепловой эффект химических реакций
- 7. Рассмотрим два возможных случая: 1. E реагентов > E продуктов. Исходя из закона сохранения энергии, в
- 8. 2. Е реагентов Реакции, при протекании которых энергия поглощается из окружающей среды, называют эндотермическими.
- 9. Энергия, которая выделяется или поглощается в химической реакции, называется, тепловым эффектом этой реакции. Этот термин используют
- 10. Уравнение химической реакции, в котором указан тепловой эффект, называется термохимическим уравнением. Например, термохимическое уравнение: 2Н2 +
- 11. Знание тепловых эффектов химических реакций имеет большое практическое значение. Например, при проектировании химического реактора важно предусмотреть
- 12. Расчёт теплового эффекта реакции Если реакция проходит между несложными молекулами, то подсчитать тепловой эффект реакции достаточно
- 13. А как, например, рассчитать тепловой эффект реакции разложения карбоната кальция? Ведь это соединение немолекулярного строения. Как
- 14. Например, сжигая уголь в кислороде, нельзя определить Qобр угарного газа СО, так как всегда идет и
- 15. Тепловой эффект химической реакции равен сумме теплот образования всех продуктов реакции минус сумма теплот образования всех
- 16. Если данное химическое соединение можно непосредственно получить из простых веществ, причем реакция идет количественно (100% -ный
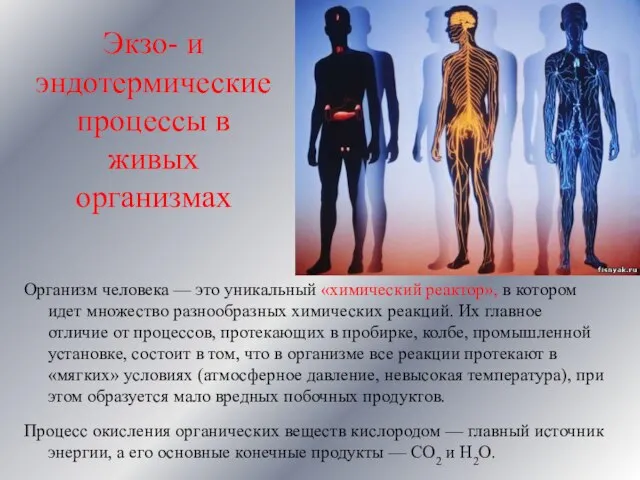
- 17. Экзо- и эндотермические процессы в живых организмах Организм человека — это уникальный «химический реактор», в котором
- 18. Эта выделившаяся энергия представляет собой большую величину, и если бы пища окислялась в организме быстро и
- 19. Каждый человек должен хотя бы приблизительно представлять, сколько энергии поступает в его организм с пищей и
- 20. Наиболее полезно питание с невысокой калорийностью, но с наличием всех компонентов в пище (белков, жиров, углеводов,
- 21. Энтропия Энергетическая ценность продуктов питания и теплотворная способность топлива связаны с экзотермическими реакциями их окисления. Движущей
- 22. Представьте, что вы в стакан насыпали разные орехи. Практически невозможно добиться при встряхивании их расслоения, упорядоченности,
- 23. Энтропия газов значительно превышает энтропию жидких и тем более твердых тел. Если вы прольете немного бензина
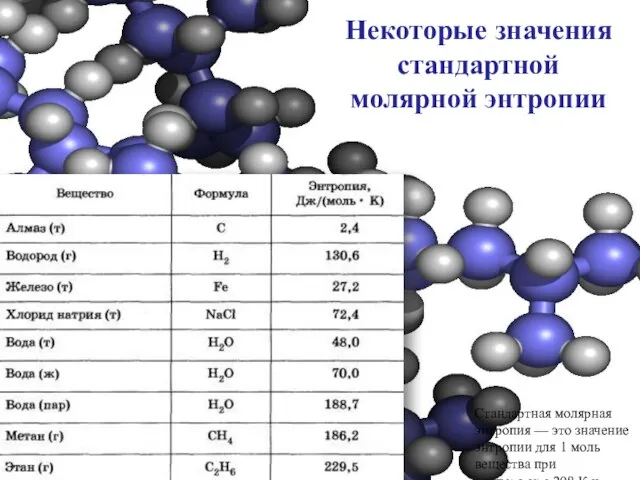
- 24. Некоторые значения стандартной молярной энтропии Стандартная молярная энтропия — это значение энтропии для 1 моль вещества
- 25. Анализируя данные, приведенные в таблице, обратите внимание, насколько мало значение энтропии для алмаза, имеющего очень правильную
- 26. Выводы: 1. Направление химической реакции определяется двумя факторами: стремлением к уменьшению внутренней энергии с выделением энергии
- 27. Существуют экспериментальные и теоретические методы определения знтропий различных химических соединений. Используя эти методы, можно количественно рассчитать
- 29. Скачать презентацию























 Сахароза, крахмал, целлюлоза
Сахароза, крахмал, целлюлоза Условия среды, вызывающие коррозию металла
Условия среды, вызывающие коррозию металла Очистка различных поверхностей от нефтяных загрязнений
Очистка различных поверхностей от нефтяных загрязнений Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 СОСТАВИТЬ ФОРМУЛУ
СОСТАВИТЬ ФОРМУЛУ Простые вещества – металлы. Общие физические свойства металлов
Простые вещества – металлы. Общие физические свойства металлов Способы получения металлов
Способы получения металлов Превращения вещества
Превращения вещества Презентация на тему Лабораторное оборудование. Посуда и средства защиты
Презентация на тему Лабораторное оборудование. Посуда и средства защиты  Строение атома. Экзаменационные вопросы
Строение атома. Экзаменационные вопросы Соли, их классификация и свойства
Соли, их классификация и свойства Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка
Окислительновосстановительные индикаторы. Задача 12 Команда: Мастера Беспорядка Химия. Вещества. 8 класс
Химия. Вещества. 8 класс Производство серной кислоты
Производство серной кислоты Углеводы. Стереохимия углеводов в проекциях Фишера
Углеводы. Стереохимия углеводов в проекциях Фишера Молекулярно-массовое распределение
Молекулярно-массовое распределение Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия
Министерство сельского хозяйства Российской Федерации. Поляграфия и фотоэлектронная спектроскопия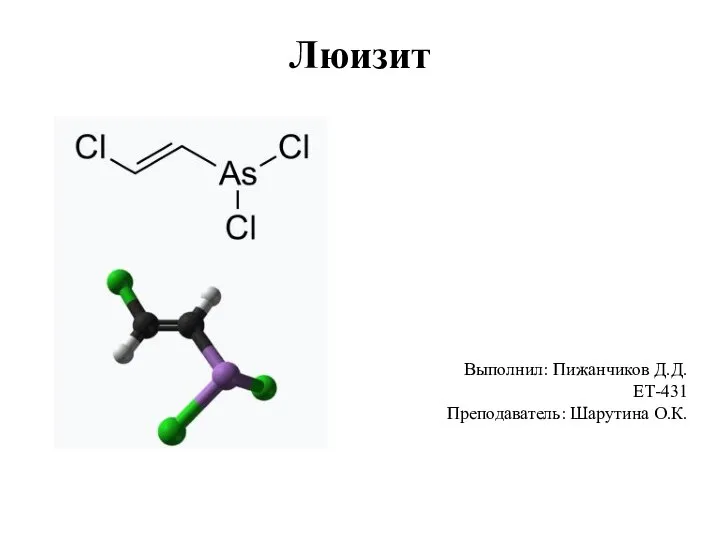 Люизит. Физические и химические свойства вещества. Действие на организм человека
Люизит. Физические и химические свойства вещества. Действие на организм человека Презентация на тему Индикаторы
Презентация на тему Индикаторы  Основания. Классификация
Основания. Классификация Вещество как система. Основы классификации и номенклатуры неорганических веществ
Вещество как система. Основы классификации и номенклатуры неорганических веществ Изучение геохимических свойств редкоземельных элементов
Изучение геохимических свойств редкоземельных элементов Презентация на тему Игра «Путешествие в страну Атомолия»
Презентация на тему Игра «Путешествие в страну Атомолия»  Алкены
Алкены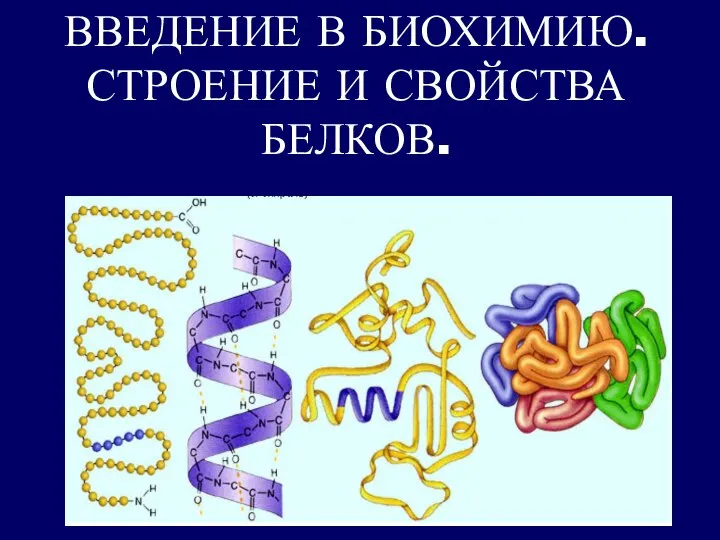 Введение в биохимию. Строение и свойства белков
Введение в биохимию. Строение и свойства белков Транспорт веществ
Транспорт веществ Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]