Содержание
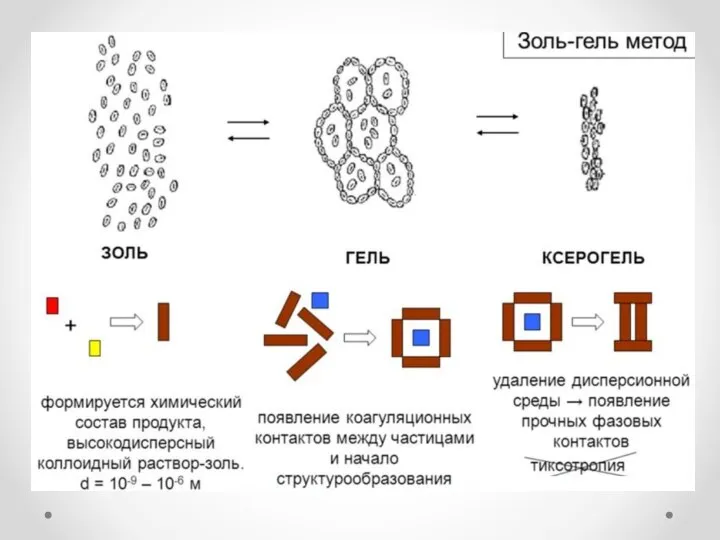
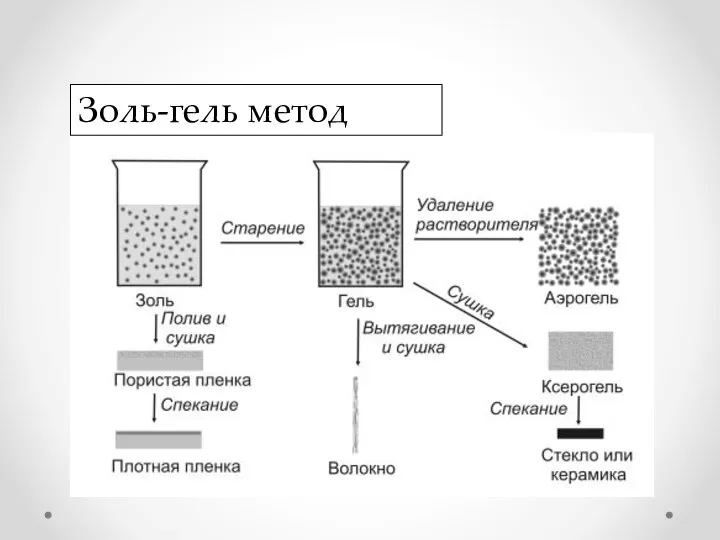
- 4. Золь-гель метод
- 5. Преимущества: Высокая реакционная способность к нулеофильным частицам При гидролизе не образуется побочных продуктов Возможность влиять на
- 6. Основан на гидролизе алкоксидов Me(OR)n + H2O → HO-Me(OR)(n-1) + ROH При гидролизе происходит образование димера
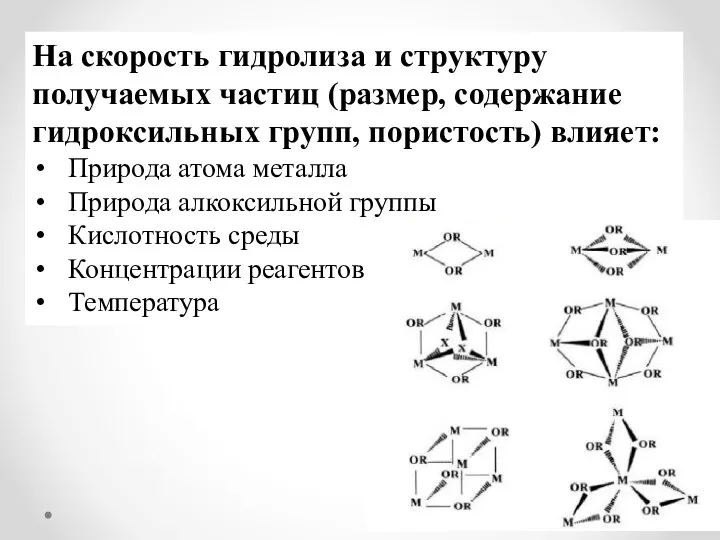
- 7. На скорость гидролиза и структуру получаемых частиц (размер, содержание гидроксильных групп, пористость) влияет: Природа атома металла
- 8. Природа металла: Атомы переходных металлов более активны по отношению к реакциям нуклеофильного замещения, благодаря перекрыванию d-
- 9. Природа алкоксильной группы: Разветвленный углеводородный остаток молекулы алкоксида создает пространственные затруднения для образования олигомеров.
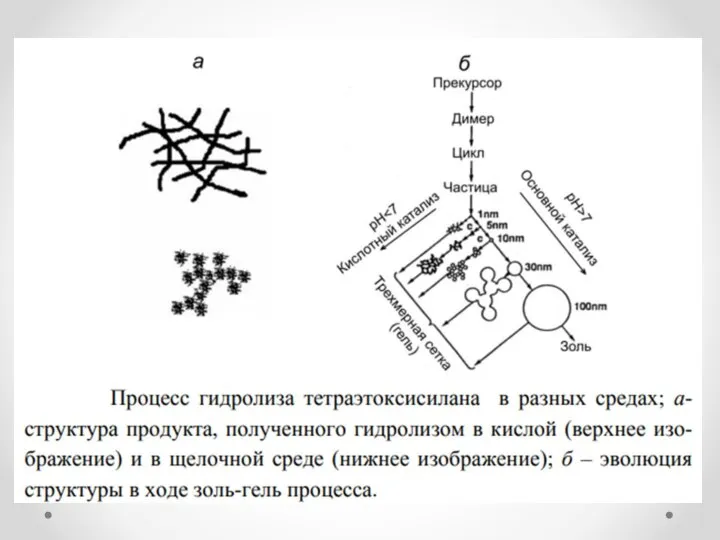
- 10. Кислотность среды: Кислотный катализ Чем более отрицательный заряд на кислороде, тем быстрее реакция При кислотном катализе
- 11. Кислотность среды: Основной катализ Чем более положительный заряд на металле, тем быстрее реакция При основном катализе
- 13. Влияние растворителя: Молярное соотношение H2O/(C2H5O)4Si в зависимости от целей синтеза меняется от 1:50 до 1:0,01.
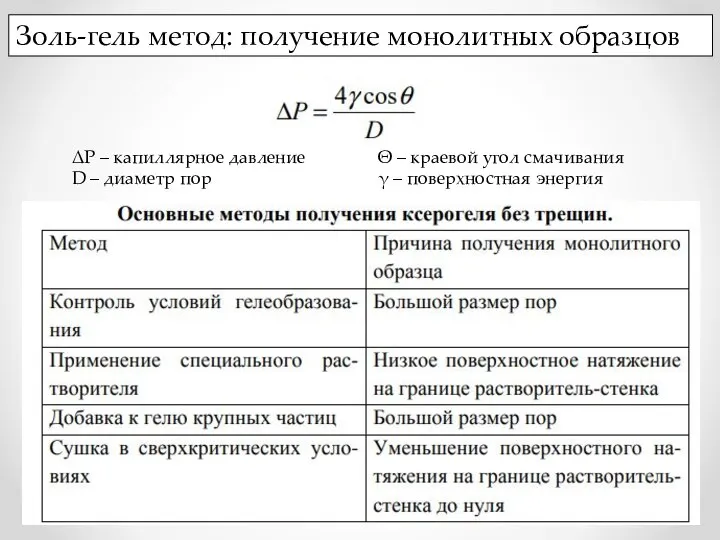
- 14. Золь-гель метод: получение монолитных образцов ΔР – капиллярное давление D – диаметр пор Θ – краевой
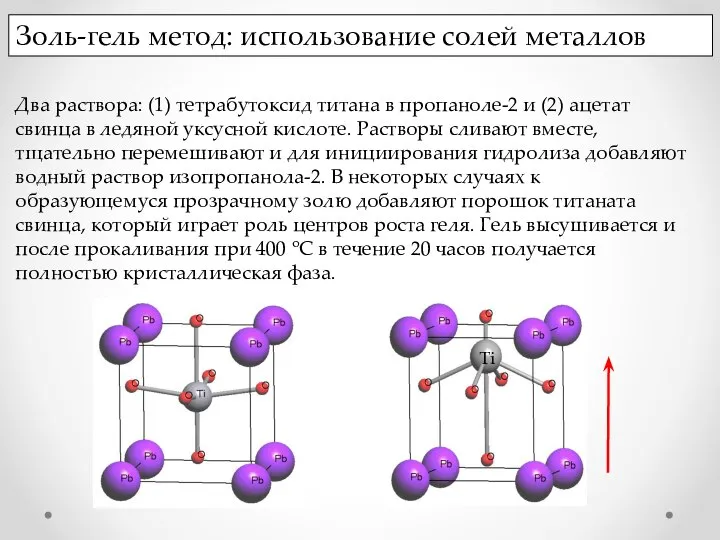
- 15. Золь-гель метод: использование солей металлов Два раствора: (1) тетрабутоксид титана в пропаноле-2 и (2) ацетат свинца
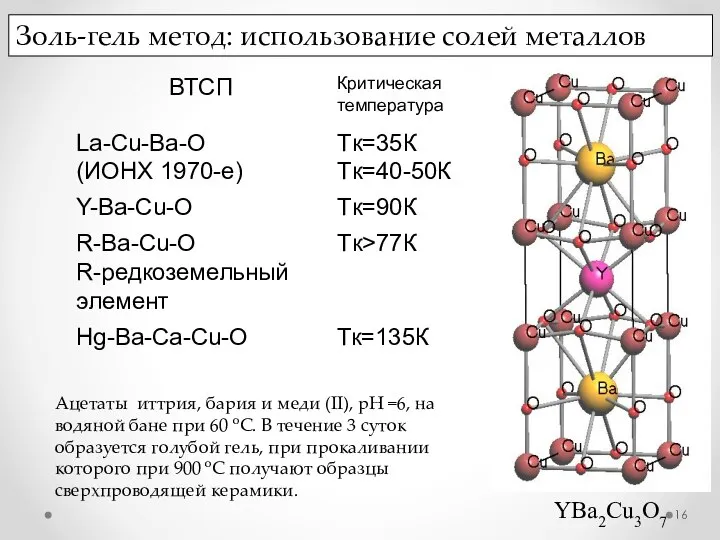
- 16. YBa2Cu3O7 Золь-гель метод: использование солей металлов Ацетаты иттрия, бария и меди (II), рН =6, на водяной
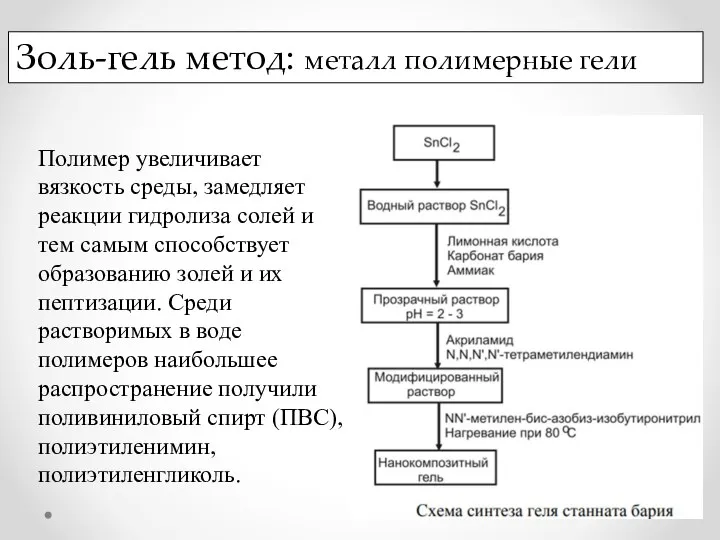
- 17. Золь-гель метод: металл полимерные гели Полимер увеличивает вязкость среды, замедляет реакции гидролиза солей и тем самым
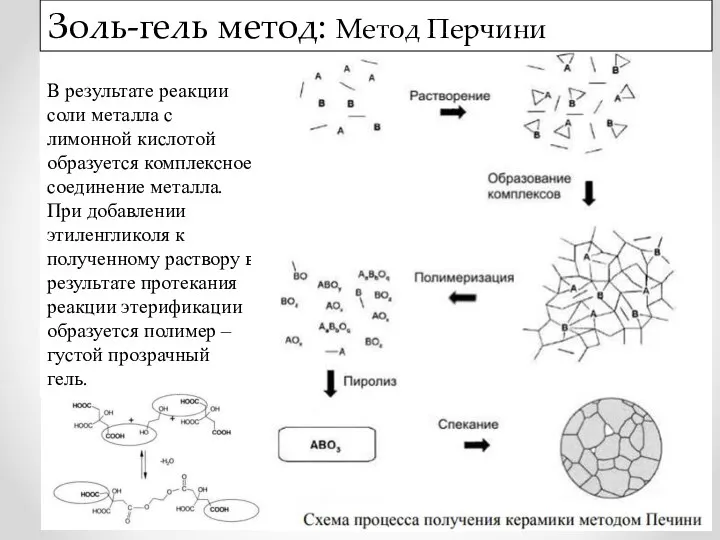
- 18. В результате реакции соли металла с лимонной кислотой образуется комплексное соединение металла. При добавлении этиленгликоля к
- 19. Преимущества: Метод позволяет синтезировать нанокристаллические порошки прокаливанием геля при более низкой температуре, чем при стандартном твердофазном
- 20. Золь-гель метод: синтез неоксидных наночастиц Реакции нитридизации аммиаком ксерогеля SiO2 Адсорбция аммиака NH3 газ → NH3
- 21. Золь-гель метод: Синтез фторидов металлов La(CF3COO)3 → LaF3 + (CF3CO)2O + CO + CO2 Фториды щелочных,
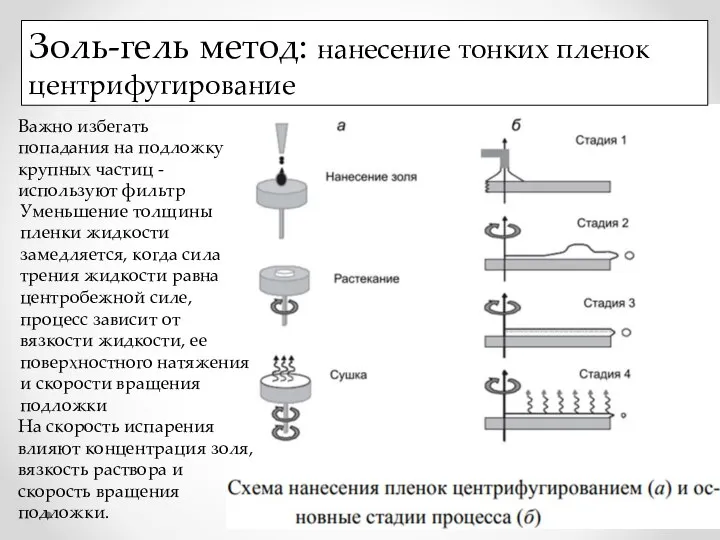
- 22. Золь-гель метод: нанесение тонких пленок центрифугирование Важно избегать попадания на подложку крупных частиц - используют фильтр
- 23. Золь-гель метод: нанесение тонких пленок вытягивание Вытягивание. Чем выше вязкость раствора и концентрация наночастиц, тем больше
- 24. Преимущества: Дешевый и простой. Пленки можно наносить на поверхности сложной формы, Можно создавать покрытия от сверхтонких
- 26. Скачать презентацию













 Презентация на тему Характеристика высокомолекулярных соединений
Презентация на тему Характеристика высокомолекулярных соединений  Этапы аналитических работ
Этапы аналитических работ Альдегиды и кетоны
Альдегиды и кетоны Предельные одноатомные спирты
Предельные одноатомные спирты Процессы минералообразования
Процессы минералообразования Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства
Общая характеристика элементов подгруппы углерода. Углерод – его строение и свойства МОУ Воротынская средняя школа Влияние бытовой химии на здоровье человека исследовательская работа Автор работы: Бызина Ирина, уч
МОУ Воротынская средняя школа Влияние бытовой химии на здоровье человека исследовательская работа Автор работы: Бызина Ирина, уч Опасная бытовая химия!
Опасная бытовая химия! Окислительно-восстановительные реакции (1)
Окислительно-восстановительные реакции (1) Закон сохранения массы веществ
Закон сохранения массы веществ Производство нитрата аммония (лекция 16)
Производство нитрата аммония (лекция 16) Демокрит его вклад в развитие взглядов на строение вещества
Демокрит его вклад в развитие взглядов на строение вещества Химия. 8 класс. Подготовка к контрольной работе
Химия. 8 класс. Подготовка к контрольной работе Алкины. Понятие об алкинах
Алкины. Понятие об алкинах Основной закон радиоактивного распада и активность радионуклидов
Основной закон радиоактивного распада и активность радионуклидов Углеводороды
Углеводороды Стан електронів у атомі
Стан електронів у атомі Формирование УУД и познавательных приемов на уроках химии
Формирование УУД и познавательных приемов на уроках химии Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений Электронное строение атомов бора и фосфора
Электронное строение атомов бора и фосфора Типы химических реакций. Решение примеров
Типы химических реакций. Решение примеров Развитие познавательной активности творческих способностей и индивидуализация на уроках химии
Развитие познавательной активности творческих способностей и индивидуализация на уроках химии Химический состав клетки
Химический состав клетки Презентация на тему Вредное воздействие нитратов на организм человека
Презентация на тему Вредное воздействие нитратов на организм человека  Электролитическая диссоциация
Электролитическая диссоциация Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Учебник системы учебно-методических комплектов Алгоритм успеха
Учебник системы учебно-методических комплектов Алгоритм успеха Л-1-5
Л-1-5