Содержание
- 2. Понятие окислительно-восстановительных реакций Химические реакции, протекающие с изменением степени окисления элементов, входящих в состав реагирующих веществ,
- 3. Окисление - процесс отдачи электронов атомом, молекулой или ионом. Атом превращается в положительно заряженный ион: Zn0
- 4. Восстановление - процесс присоединения электронов атомом, молекулой или ионом. Атом превращается в отрицательно заряженный ион S0
- 5. Восстановители - атомы, молекулы или ионы, отдающие электроны. Они в процессе ОВР окисляются Типичные восстановители: ●
- 6. Окислители - атомы, молекулы или ионы, присоединяющие электроны. Они в процессе ОВР восстанавливаются Типичные окислители: ●
- 7. На проявление окислительно-восстановительных свойств влияет такой фактор, как устойчивость молекулы или иона. Чем прочнее частица, тем
- 8. Например, азот имеет высокую электроотрицательность и мог бы быть сильным окислителем в виде простого вещества, но
- 9. Или НСLO более сильный окислитель в растворе, чем НСLO4, так как НСLO – менее устойчивая кислота.
- 10. Если химический элемент находится в промежуточной степени окисления, то он проявляет свойства и окислителя, и восстановителя.
- 11. Степени окисления серы: -2,0,+4,+6 Н2S-2 - восстановитель 2Н2S+3O2=2H2O+2SO2 S0,S+4O2 – окислитель и восстановитель S+O2=SO2 2SO2+O2=2SO3 (восстановитель)
- 12. Определение степеней окисления атомов химических элементов С.о. атомов х/э в составе простого вущества = 0 Алгебраическая
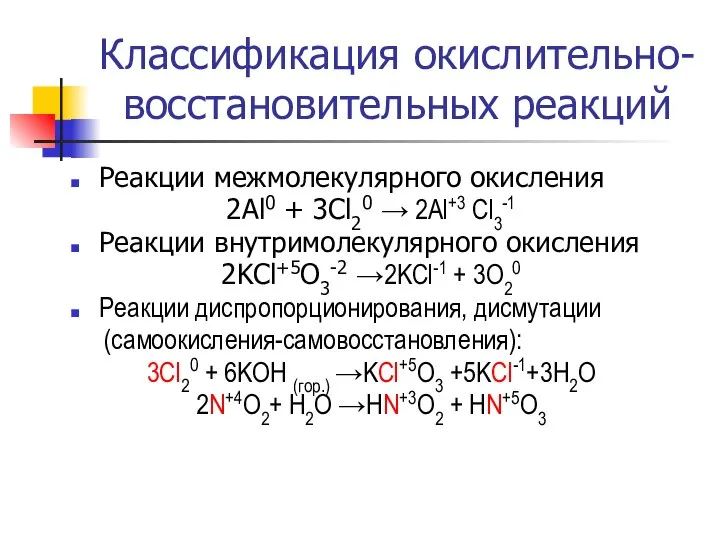
- 13. Классификация окислительно-восстановительных реакций Реакции межмолекулярного окисления 2Al0 + 3Cl20 → 2Al+3 Cl3-1 Реакции внутримолекулярного окисления 2KCl+5O3-2
- 14. Это полезно знать Степени окисления элементов в составе аниона соли такие же, как и в кислоте,
- 15. Окислительные свойства концентрированной серной кислоты Продукты восстановления серы: H2SO4 + оч.акт. металл (Mg, Li, Na…) →
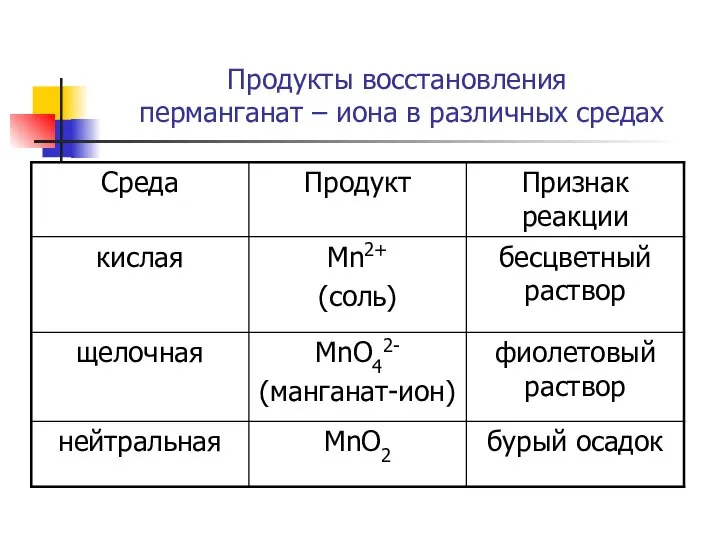
- 16. Продукты восстановления перманганат – иона в различных средах
- 17. Пероксид водорода в окислительно-восстановительных реакциях
- 18. Азотная кислота в окислительно-восстановительных реакциях Продукты восстановления азота: Концентрированная HNO3: N+5 +1e → N+4 (NO2) (Ni,
- 20. Скачать презентацию















 Основные классы неорганических соединений
Основные классы неорганических соединений Презентация на тему: Изомерия
Презентация на тему: Изомерия Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения
Технология одноступенчатого гидрокрекинга. Аппаратное оформление и основные технологические решения Презентация на тему Кремний
Презентация на тему Кремний  Характеристика элемента по его положению в периодической системе
Характеристика элемента по его положению в периодической системе Общие свойства неметаллов
Общие свойства неметаллов Презентация по Химии "Химическая номенклатура и филология"
Презентация по Химии "Химическая номенклатура и филология"  Особенности органических веществ
Особенности органических веществ Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем Структура периодической таблицы элементов
Структура периодической таблицы элементов Растворы, классификация растворов
Растворы, классификация растворов Контроль знаний на уроках химии
Контроль знаний на уроках химии Классификация силикатов
Классификация силикатов Химические вещества
Химические вещества Соединения серы
Соединения серы Полиморфизм. Аморфные вещества
Полиморфизм. Аморфные вещества Ароматические углеводороды
Ароматические углеводороды Ионная связь. Вещества ионного ( немолекулярного) строения
Ионная связь. Вещества ионного ( немолекулярного) строения Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса Натуральный каучук
Натуральный каучук Спирты или алканолы
Спирты или алканолы Нефть. Состав, свойства, переработка
Нефть. Состав, свойства, переработка Периодический закон Д.И. Менделеева
Периодический закон Д.И. Менделеева Решение задач на нахождение молекулярной формулы газообразного алкана
Решение задач на нахождение молекулярной формулы газообразного алкана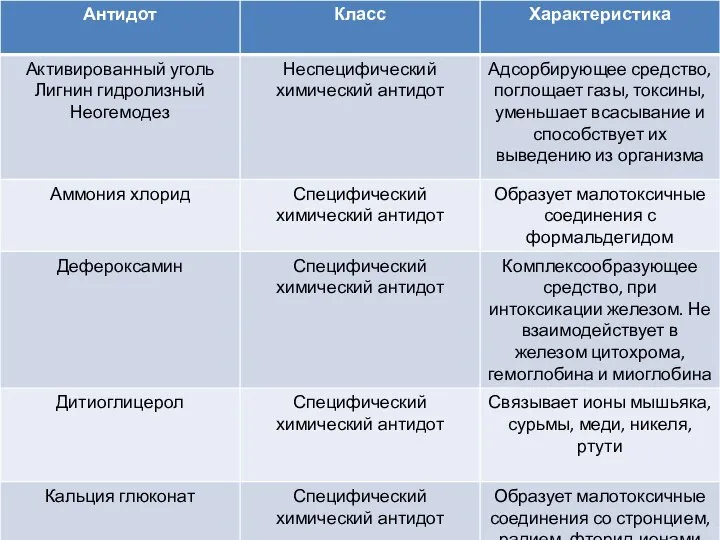 Антидоты. Класс. Характеристика
Антидоты. Класс. Характеристика Кислоты 8 класс - Презентация_
Кислоты 8 класс - Презентация_ Классификация химических реакций
Классификация химических реакций Презентация на тему Обратимость химических реакций. Химическое равновесие
Презентация на тему Обратимость химических реакций. Химическое равновесие