Содержание
- 2. Гидролиз- химическое взаимодействие солей с водой, приводящее к образованию слабого электролита. Образование слабого электролита – обязательное
- 3. Соли - продукты взаимодействия кислот с основаниями. Различают четыре типа солей: 1 - соли, образованные сильной
- 4. NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е й т р а
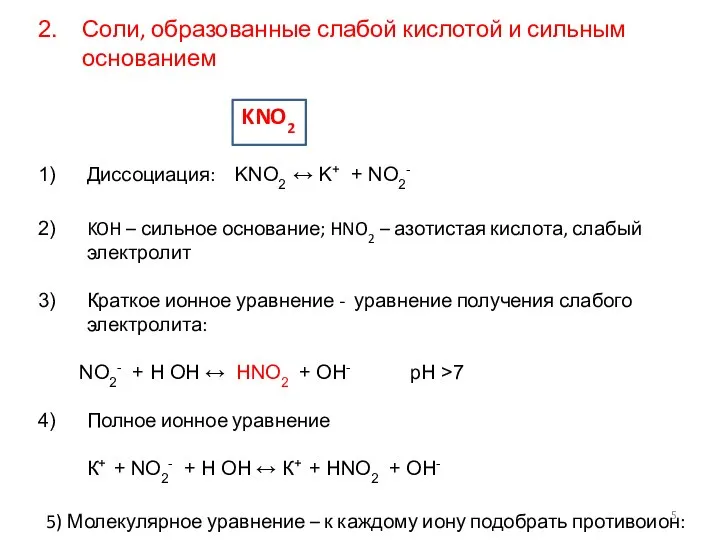
- 5. Соли, образованные слабой кислотой и сильным основанием KNO2 Диссоциация: KNO2 ↔ K+ + NO2- KOH –
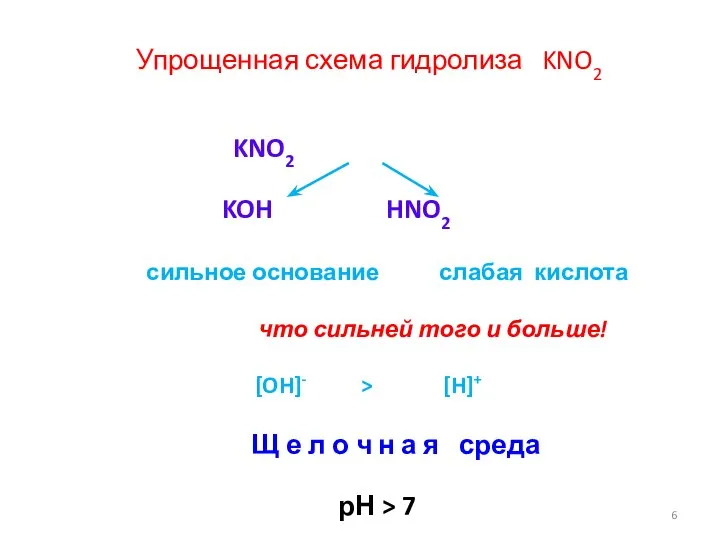
- 6. KNO2 KOH HNO2 сильное основание слабая кислота что сильней того и больше! [OH]- > [H]+ Щ
- 7. 3. Соли, образованные слабыми основаниями и сильными кислотами FeCl3 Диссоциация FeCl3 Fe3+ + 3Cl- HCl –
- 8. II ступень Fe(OH)Cl2 ↔ Fe(OH)2+ + 2Cl- Fe(OH)2+ + HOH ↔ Fe(OH)2+ + H+ Fe(OH)2+ +
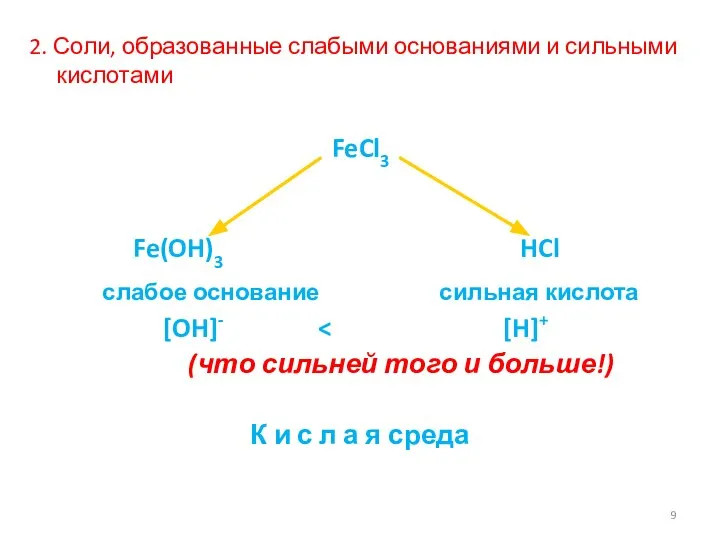
- 9. 2. Соли, образованные слабыми основаниями и сильными кислотами FeCl3 Fe(OH)3 HCl слабое основание сильная кислота [OH]-
- 10. Соль образована слабым основанием и слабой кислотой. 1. Диссоциация: CH3COONH4 ↔ CH3COO- + NH4+ CH3COOH –
- 11. NH4NO2 → NH4+ + NO2- NH4OH – слабое основание; HNO2 – слабая кислота NH4+ + NO2-
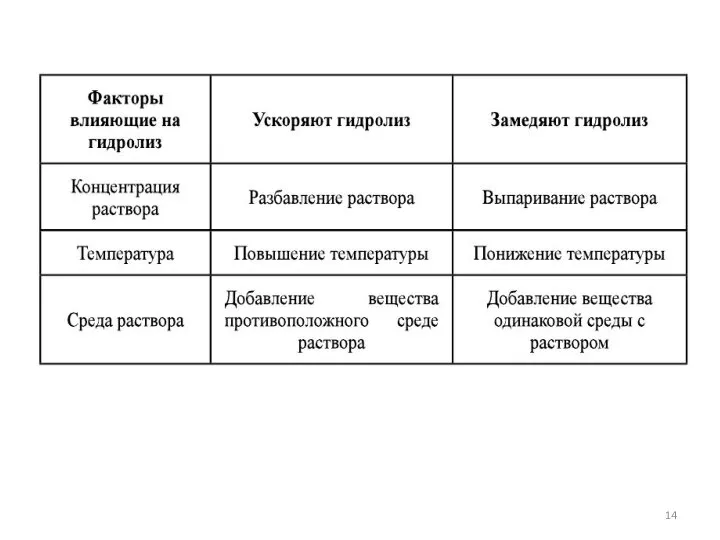
- 12. Степень гидролиза αг - доля гидролизованных единиц: Константа гидролиза - Кг. Количественные характеристики гидролиза
- 13. Константа гидролиза Константа гидролиза выводится по краткому ионному равновесию. Na2CO3 ↔ Na+ + CO32- CO32- +
- 15. Между Кг и αг существует такая же связь, как между Кд и αд : Константа гидролиза
- 17. Скачать презентацию


![NaCl NaOH HCl сильное основание сильная кислота [OH]- = [H]+ Н е](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1180218/slide-3.jpg)







 Винилпиридиновые каучуки
Винилпиридиновые каучуки Кислород O2
Кислород O2 Окислительно-восстановительные реакции. 8 класс
Окислительно-восстановительные реакции. 8 класс Презентация по Химии "Химия в сельском хозяйстве"
Презентация по Химии "Химия в сельском хозяйстве"  Фестиваль песчаных скульптур
Фестиваль песчаных скульптур Химия и жизнь
Химия и жизнь Термохимическое уравнение реакции полного сгорания ацетилена
Термохимическое уравнение реакции полного сгорания ацетилена Этиленгликоль
Этиленгликоль Презентация на тему Валентные состояния атома углерода
Презентация на тему Валентные состояния атома углерода  Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О
Исследовательская работа на тему: «Выращивание кристалла в домашних условиях» Работу выполнила ученица 10-а класса Алексеева О Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Алкины: получение и свойства
Алкины: получение и свойства Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты Основные понятия и представления о химии. Тела и среды. Представление о системах
Основные понятия и представления о химии. Тела и среды. Представление о системах Подготовка к контрольной работе Неметаллы
Подготовка к контрольной работе Неметаллы Полезные ископаемые
Полезные ископаемые Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Презентация на тему Выбирай вопрос и отвечай
Презентация на тему Выбирай вопрос и отвечай  Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1)
Алкины, гомологический ряд алкинов. Электронное и пространственное строение алкинов на примере ацетилена (1) Кремний. Германий, олово, свинец (Лекция № 6)
Кремний. Германий, олово, свинец (Лекция № 6) Коагуляция в дисперсных системах
Коагуляция в дисперсных системах Электролитическая диссоциация
Электролитическая диссоциация Получение этиленгликоля
Получение этиленгликоля Разработка системы подготовки лаборанта химического анализа
Разработка системы подготовки лаборанта химического анализа Составление уравнений окислительно-восстановительных реакций
Составление уравнений окислительно-восстановительных реакций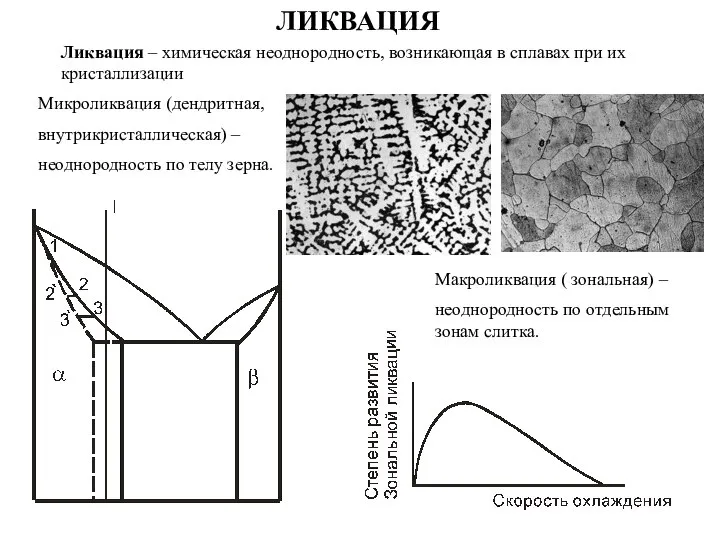 Ликвация – химическая неоднородность
Ликвация – химическая неоднородность Гидрометаллургическое обескремнивание титанового сырья соединениями фтора
Гидрометаллургическое обескремнивание титанового сырья соединениями фтора