Реализация системно-деятельностного подхода совместно с компьютерными технологиями в преподавании химии
Содержание
- 2. Системно-деятельностный подход Позиция учителя: к классу с вопросом. Позиция ученика: за познанием мира,(в специально организованных для
- 3. 1 этап. Организационный, целеполагание. Цель деятельности учителя: Создать условия для выхода учащихся на постановку учебной цели.
- 4. Постановка проблемы с помощью эксперимента: Опыт №1 Железо+ нитрат меди= Действие: Наблюдение Опыт №2 Цинк+ нитрат
- 5. Вставьте в текст пропущенные слова: 1 Элемент находится в 3 периоде, 7 группе, главной подгруппе. 2
- 6. Тема: КИСЛОТЫ.
- 7. Девиз урока: «Всё познаётся в сравнении» Тема урока: Кислоты
- 8. Цель: научиться отличать кислоты по формулам и по цвету индикатора.
- 9. План изучения темы: Классификация кислот Отличие кислот по цвету индикатора.
- 10. 2 этап. Изучение нового учебного материала. Цель деятельности учителя: Создать условия учащимися для определения классификации и
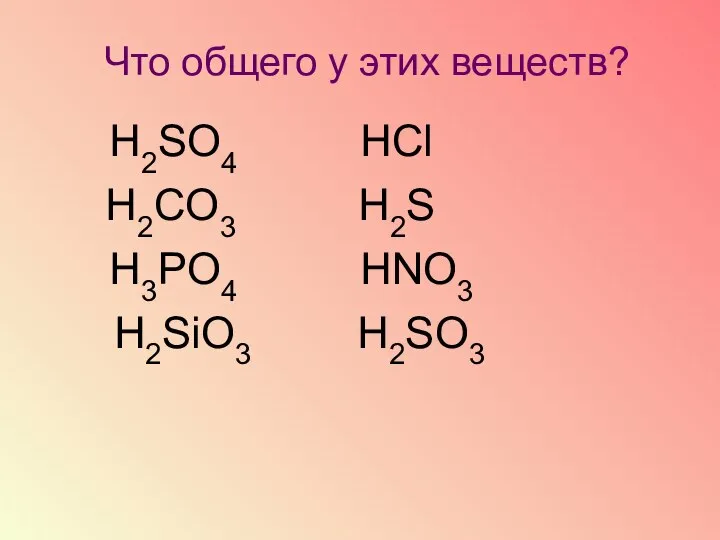
- 11. Что общего у этих веществ? Н2SO4 НСl Н2CO3 Н2S Н3РO4 НNO3 Н2SiO3 Н2SO3
- 12. Что такое кислоты? Сложные вещества, молекулы которых состоят из атомов водорода и кислотного остатка
- 13. Рассмотрите формулы кислот и найдите сходство между ними. Дайте определение кислот.
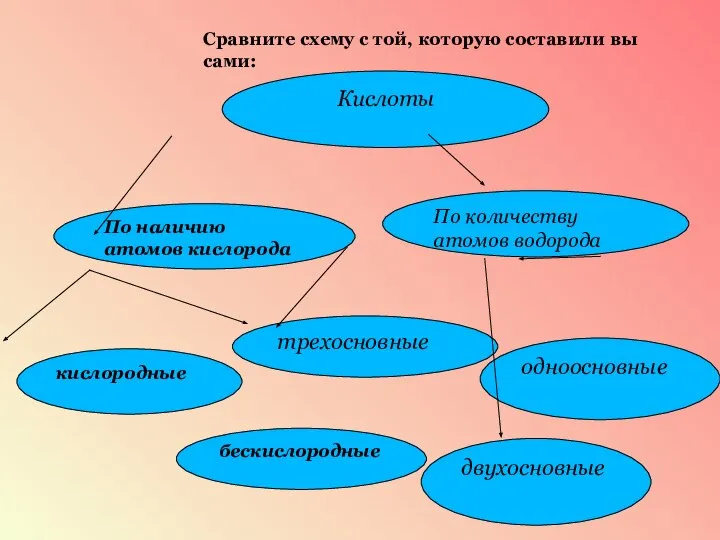
- 14. Сравните схему с той, которую составили вы сами: Кислоты По наличию атомов кислорода По количеству атомов
- 15. Как вы думаете, можно ли отличить кислоты от других веществ? Подумайте, в какой цвет будут изменять
- 16. Осторожно: Не забудь: Если на руку тебе кислота попала, Руку быстро промой водой из-под крана И,
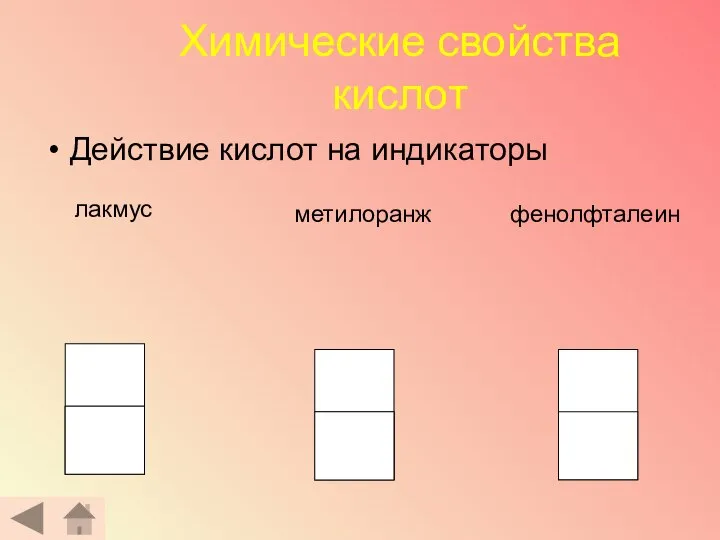
- 17. Проведем небольшое исследование. Какова его цель? - Проверить, как изменяют окраску индикаторы в растворах кислот. Помни!
- 18. Химические свойства кислот Действие кислот на индикаторы лакмус метилоранж фенолфталеин
- 19. Заполните таблицу: Сделайте вывод: Независимо от вида кислоты, индикаторы изменяют свой цвет одинаково, а это означает,
- 20. Синквейн Например: 1 – водород; 2 – бесцветный, легкий. 3 – реагирует, восстанавливает, сгорает; 4 –
- 21. Решать задачи по алгоритму. Например, алгоритм нахождения массовой доли растворенного вещества: Последовательность действий: 1. Прочитайте текст
- 22. 3 этап. Закрепление знаний и умений. Цель деятельности учителя: Создать условия для закрепления изученной информации об
- 23. Задание №1 Используя таблицу растворимости кислот, оснований и солей в воде, составьте формулы разных кислот из
- 24. Рефлексия. Продолжить предложение: сегодня я узнал… было интересно… было трудно… я выполнял задания… я понял, что…
- 25. Д/З ! 1. П. 20, упр. 3, стр. 107 2. Задание по выбору: - Подготовить сообщение
- 26. Системно-деятельностный подход в преподавании химии. Формирования следующих видов деятельности: познавательной деятельности; информационно-коммуникативной деятельности; рефлексивной деятельности;
- 28. Скачать презентацию






















 Пиримидин (шестичленный гетероцикл с двумя атомами азота)
Пиримидин (шестичленный гетероцикл с двумя атомами азота) Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Витамины. (10 класс)
Витамины. (10 класс) Контроль качества лекарственных средств, производных карбоновых кислот и аминокислот
Контроль качества лекарственных средств, производных карбоновых кислот и аминокислот Галогениды. Лекция 11
Галогениды. Лекция 11 Водорастворимые витамины. 7 свойств водорастворимых витаминов
Водорастворимые витамины. 7 свойств водорастворимых витаминов Кислотные оксиды, основные оксиды, индикаторы
Кислотные оксиды, основные оксиды, индикаторы Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Переработка нефти
Переработка нефти Дидактическое сопровождение курса Мир органических соединений
Дидактическое сопровождение курса Мир органических соединений Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура Посвящение в химики
Посвящение в химики Необратимый (совместный) гидролиз
Необратимый (совместный) гидролиз Пероксид щелочных металлов
Пероксид щелочных металлов Жиры (липиды)
Жиры (липиды) Общая характеристика галогенов. 9 класс
Общая характеристика галогенов. 9 класс Признаки химических реакций
Признаки химических реакций Строение электронных оболочек атомов. 8 класс
Строение электронных оболочек атомов. 8 класс Растворы полимеров
Растворы полимеров Презентация на тему Оксиды углерода
Презентация на тему Оксиды углерода  Фуллерены
Фуллерены Prezentatsia1_1
Prezentatsia1_1 Введение в медицинскую химию: от молекулы к лекарству
Введение в медицинскую химию: от молекулы к лекарству Особенности решения практикоориентированного задания №26 ГИА-11
Особенности решения практикоориентированного задания №26 ГИА-11 Основные понятия химии
Основные понятия химии Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12
Проект синтеза бензина для промышленных целей отделения Д-3 цеха Д 2-6-3-5-12 Равновесия в растворах электролитов. Окислительно-восстановительные реакции
Равновесия в растворах электролитов. Окислительно-восстановительные реакции Тема_6б_химическая_кинетика
Тема_6б_химическая_кинетика