Содержание
- 2. Строение атома железа
- 3. Получение железа Промышленное железо получают выплавкой чугуна и стали. Чугун - это сплав железа с примесями
- 4. Физическое свойство железа В чистом виде при нормальных условиях это твердое вещество. Оно обладает серебристо-серым цветом
- 5. Химическое свойство железа 1)На воздухе железо легко окисляется в присутствии влаги (ржавление): 4Fe + 3O2 +
- 6. Применение железа Железо — один из самых используемых металлов, на него приходится до 95 % мирового
- 8. Скачать презентацию
Слайд 3Получение железа
Промышленное железо получают выплавкой чугуна и стали.
Чугун - это сплав железа
Получение железа
Промышленное железо получают выплавкой чугуна и стали.
Чугун - это сплав железа

с примесями кремния, марганца, серы, фосфора, углерода. Содержание углерода в чугуне превышает 2% (в стали менее 2%).
Чистое железо получают:
в кислородных конверторах из чугуна;
восстановлением оксидов железа водородом и двухвалентным оксидом углерода;
электролизом соответствующих солей.
Чугун получают из железных руд восстановлением оксидов железа. Выплавку чугуна осуществляют в доменных печах. В качестве источника тепла в доменной печи используется кокс.
Процесс выплавки чугуна в доменной печи идет непрерывно в течение нескольких десятилетий, пока печь не выработает свой ресурс.
Чистое железо получают:
в кислородных конверторах из чугуна;
восстановлением оксидов железа водородом и двухвалентным оксидом углерода;
электролизом соответствующих солей.
Чугун получают из железных руд восстановлением оксидов железа. Выплавку чугуна осуществляют в доменных печах. В качестве источника тепла в доменной печи используется кокс.
Процесс выплавки чугуна в доменной печи идет непрерывно в течение нескольких десятилетий, пока печь не выработает свой ресурс.
Слайд 4Физическое свойство железа
В чистом виде при нормальных условиях это твердое вещество. Оно
Физическое свойство железа
В чистом виде при нормальных условиях это твердое вещество. Оно

обладает серебристо-серым цветом и ярко выраженным металлическим блеском. Механические свойства железа включают в себя уровень твердости по шкале Мооса. Она равна четырем (средняя). Железо обладает хорошей электропроводностью и теплопроводностью. Последнюю особенность можно ощутить, дотронувшись до железного предмета в холодном помещении. Так как этот материал быстро проводит тепло, он за короткий промежуток времени забирает большую его часть из вашей кожи, и поэтому вы ощущаете холод. Дотронувшись, к примеру, до дерева, можно отметить, что его теплопроводность намного ниже. Физические свойства железа — это и его температуры плавления и кипения. Первая составляет 1539 градусов по шкале Цельсия, вторая — 2860 градусов по Цельсию. Можно сделать вывод, что характерные свойства железа — хорошая пластичность и легкоплавкость.
Слайд 5Химическое свойство железа
1)На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe +
Химическое свойство железа
1)На воздухе железо легко окисляется в присутствии влаги (ржавление):
4Fe +

3O2 + 6H2 O → 4Fe(OH)3
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа
3Fe + 2O2 → Fe3O4
2)При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t°→ Fe3O4 + 4H2
3)Железо реагирует с неметаллами при нагревании:
2Fe+3Cl2→2FeCl3 (200 °С)
2Fe + 3Br2 –t°→ 2FeBr3
Fe + S –t°→ FeS (600 °С)
Fe+2S → Fe+2(S2-1) (700°С)
и т.д.
Накалённая железная проволока горит в кислороде, образуя окалину — оксид железа
3Fe + 2O2 → Fe3O4
2)При высокой температуре (700–900°C) железо реагирует с парами воды:
3Fe + 4H2O –t°→ Fe3O4 + 4H2
3)Железо реагирует с неметаллами при нагревании:
2Fe+3Cl2→2FeCl3 (200 °С)
2Fe + 3Br2 –t°→ 2FeBr3
Fe + S –t°→ FeS (600 °С)
Fe+2S → Fe+2(S2-1) (700°С)
и т.д.
Слайд 6Применение железа
Железо — один из самых используемых металлов, на него приходится до
Применение железа
Железо — один из самых используемых металлов, на него приходится до
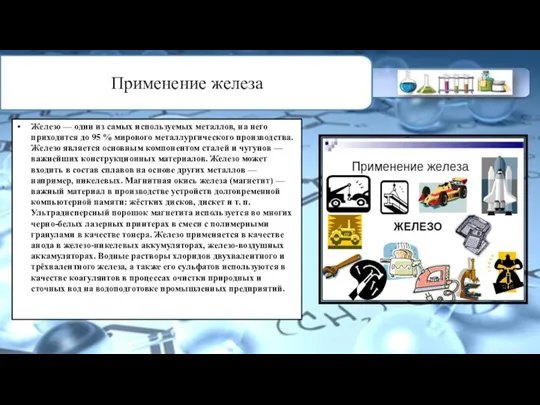
95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов. Железо может входить в состав сплавов на основе других металлов — например, никелевых. Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п. Ультрадисперсный порошок магнетита используется во многих черно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккамуляторах. Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.
- Предыдущая
Патріотизм УкраїниСледующая -
Выборы директора МИАН
 Молекулярно-массовое распределение
Молекулярно-массовое распределение Приходченко ФЕР-2031
Приходченко ФЕР-2031 Карбоновые кислоты
Карбоновые кислоты Циклоалканы. Строение молекул
Циклоалканы. Строение молекул Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4)
Количество теплоты, для получения углекислого газа. Химическое равновесие. Примеры. (Лекция 4) карбоновые кислоты
карбоновые кислоты Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства
Оксиды. Классификация, химические и физические свойства. Индивидуальные свойства Презентация на тему Сложные эфиры
Презентация на тему Сложные эфиры  Соли (8 класс)
Соли (8 класс) 564481
564481 Природные смолы: канифоль, янтарь, сандарак (2)
Природные смолы: канифоль, янтарь, сандарак (2) Своя игра по химии
Своя игра по химии Хромофорная теория кислотно-основных индикаторов
Хромофорная теория кислотно-основных индикаторов Валентные возможности атомов элементов
Валентные возможности атомов элементов Исследование молока
Исследование молока Алмаз (С)
Алмаз (С) Обозначения групп симметрии по Шенфлису
Обозначения групп симметрии по Шенфлису lektsia_5
lektsia_5 Презентация на тему Предельные одноатомные спирты
Презентация на тему Предельные одноатомные спирты  Методы изготовления из резины и латекса
Методы изготовления из резины и латекса Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки
Экспериментальное исследование кипения сверхтекучего гелия на цилиндрическом нагревателе внутри пористой оболочки Спирты и фенолы
Спирты и фенолы 10 класс Алкадиены более совершенная (2)
10 класс Алкадиены более совершенная (2) Азот и его соединения
Азот и его соединения Основания. Классификация
Основания. Классификация teoria_Butlerova
teoria_Butlerova Химия. Электролитическая диссоциация. (9 класс)
Химия. Электролитическая диссоциация. (9 класс) 9 урок простые и сложные вещества
9 урок простые и сложные вещества