Слайд 2Тест
5. Причина свечения белого фосфора….
а)изменение агрегатного состояния вещества
б) химическое явление в) физическое

явление
б) химическое явление
6.Как называются соединения фосфора с металлами
а) сульфаты б)фосфаты в) фосфиды
в) фосфиды
7.Какой тип связи в молекуле фосфина РН3
а) ковалентная неполярная б) ковалентная полярная в) ионная
а) ковалентная неполярная
8) Красный или белый фосфор ядовит?
а) красный б) белый
б) белый
9) Очень ядовит, с неприятным запахом, легко воспламеняется на воздухе, образует болотные блуждающие огни. О каком газе идет речь?
О фосфине РН3
Слайд 3Фосфор
Соединения фосфора
химия 9 класс

Слайд 4План
Оксид фосфора - Р2О5
Фосфорная кислота - Н3РО4
Соли фосфорной кислоты –
Са3

(РО4)3 Са(Н2РО4)2 СаНРО4
Слайд 5Фосфор в природе
В природе фосфор в свободном виде не встречается – только

в виде соединений. Важнейшими природными соединениями фосфора являются минералы фосфориты и апатиты.
Основную их массу составляет фосфат кальция Са3 (РО4)3, из которого и получают в промышленности фосфор.
Слайд 6Кислотный оксид Р2О5
Физические свойства
Белое гигроскопичное порошкообразное вещество.
Хорошо растворимое в воде, образует

несколько кислот.
Используется как осушитель газов и жидкостей, отнимает воду у химических соединений.
Слайд 7Кислотный оксид Р2О5
Химические свойства
1) с водой
Р2О5 + 3 Н2О = 2Н3РО4

(ортофосфорная кислота)
Р2О5 + Н2О = 2НРО3
(метафосфорная кислота)
Р2О5 + 2 Н2О = Н4Р2О7
(пирофосфорная кислота)
Слайд 8Кислотный оксид Р2О5
Химические свойства
2) с основными оксидами
Р2О5 + 3 СаО = Са3
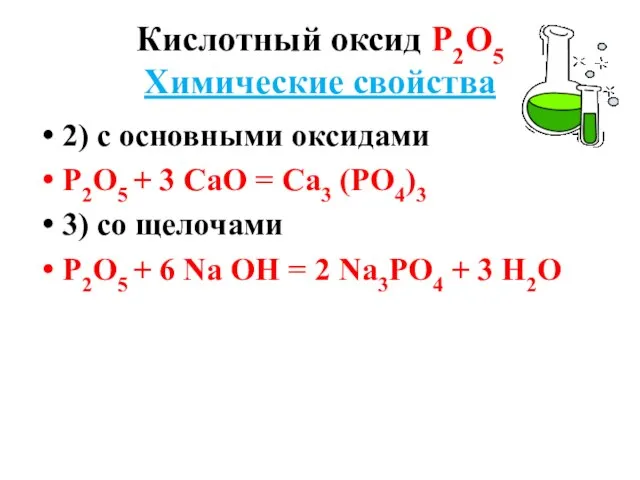
(РО4)3
3) со щелочами
Р2О5 + 6 Nа ОН = 2 Nа3РО4 + 3 Н2О
Слайд 9
Ортофосфорная кислота Н3РО4
Физические свойства
Белые прозрачные кристаллы,
не ядовита
Кислота средней силы
С

водой смешивается в любых соотношениях.
Тплав. = 42 0С, плавиться без разложения, при умеренном нагревании разлагается.
Окислительные свойства не проявляет (отличие от Н2SO4 (конц.), НNO3)
Слайд 10
Ортофосфорная кислота Н3РО4
Является трехосновной кислотой и образует три ряда солей:
1) средние соли,

или фосфаты - Са3 (РО4)3
Которые нерастворимы в воде, кроме фосфатов щелочных металлов
2) Кислые-дигидрофосфаты- Са(Н2РО4)2
Большинство из которых хорошо растворимы в воде
Слайд 11Ортофосфорная кислота Н3РО4
3) Кислые-гидрофосфаты- СаНРО4
Которые малорастворимы в воде (кроме фосфатов натрия,

калия и аммония), т.е. занимают промежуточное положение между фосфатами и дигидрофосфатами по растворимости.
Вывод: с увеличением содержания атомов водорода в молекуле соли, ее растворимость повышается.
Слайд 12
Ортофосфорная кислота Н3РО4
Химические свойства
Н3РО4 проявляет все свойства кислот
Реагирует:
1) со щелочами:

NaOH, КОН
2) с основными оксидами: Li2O, Na2O
3) c солями: К2СО3
4) с металлами не реагирует !!! ?
(см.Таблицу растворимости)
Слайд 13
Ортофосфорная кислота Н3РО4
Химические свойства
Фосфаты всех металлов (КромеЩМе) нерастворимы, поэтому на

поверхности этих металлов образуется нерастворимая пленка, препятствующая их дальнейшему растворению в кислоте.
ЩМе при растворении в кислоте, начинают взаимодействовать с водой.
Слайд 14Ортофосфорная кислота Н3РО4
Химические свойства
Некоторые реакции с металлами протекают в очень разбавленных

растворах:
2 Н3РО4 (разб) + 3 Мg = Мg3(РО4 )2↓ + 3Н2↑
Слайд 15Качественная реакция
на фосфат-ион РО43-
РО43- + 3 Ag+ = Ag3РО4 ↓

(желтый фосфат серебра)
Полученный осадок растворяется в сильных кислотах.
По этому признаку его можно отличить от других нерастворимых солей серебра желтого цвета – AgI, AgBr
AgCl – белого цвета
Слайд 16
Задание
Напишите уравнение диссоциации солей
Фосфата натрия
Гидрофосфата натрия
Дигидрофосфата натрия
Обратите внимание: средние соли диссоциируют

в 1 ступень (сильные электролиты), у кислых солей – несколько ступеней диссоциации.
Слайд 17Диссоциация солей фосфора
Вывод: Каждая последующая ступень диссоциации протекает в меньшей степени, чем

предыдущая.
Слайд 18Источники
Горковенко М.Ю. Поурочные разработки по химии: 9 класс. – М.: ВАКО, 2010.

– 368 с. – (В помощь школьному учителю).
Габриелян О.С. Химия. 9 класс: учеб. Для общеобразоват.учреждений/О.С.Габриелян. – 17-е изд.Б стереотип. –М.: Дрофа, 2010 – 270 с.:ил.

















 8. ионная связь
8. ионная связь Нуклеирующие добавки
Нуклеирующие добавки Изучение основного солевого состава брендов бутилированной воды, присутствующих на рынке России
Изучение основного солевого состава брендов бутилированной воды, присутствующих на рынке России Сeквенирование нуклеиновых кислот
Сeквенирование нуклеиновых кислот Альдегиды и кетоны
Альдегиды и кетоны Показатель активности водородных ионов. Лабораторная работа №4
Показатель активности водородных ионов. Лабораторная работа №4 Атомы, вещества, молекулы
Атомы, вещества, молекулы Cтроение жиров
Cтроение жиров Вырсова И.Е.
Вырсова И.Е. Физико-химические свойства растворов ВМС
Физико-химические свойства растворов ВМС Юные химики. Своя игра
Юные химики. Своя игра Гибридизация АО. Пространственное строение молекул (геометрия молекул)
Гибридизация АО. Пространственное строение молекул (геометрия молекул) Responsible Aluminium Framework
Responsible Aluminium Framework Свойства алмаза
Свойства алмаза Введение. Тренажер
Введение. Тренажер Растворы. 11 класс
Растворы. 11 класс Гидролиз неорганических солей
Гидролиз неорганических солей Презентация на тему Химические свойства алкенов
Презентация на тему Химические свойства алкенов  Газовые законы
Газовые законы Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Химическая география чудес
Химическая география чудес Определение Кофеина в Кофе
Определение Кофеина в Кофе Клуб юных химиков. Школа №3
Клуб юных химиков. Школа №3 Обобщающий урок по теме «Соединения химических элементов» 8 класс.
Обобщающий урок по теме «Соединения химических элементов» 8 класс. Синтез поликонденсационных полимеров
Синтез поликонденсационных полимеров Вода в природе
Вода в природе Силикатная промышленность
Силикатная промышленность Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами
Презентация на тему Гигиенические аспекты загрязнения пищевых продуктов чужеродными веществами