Содержание
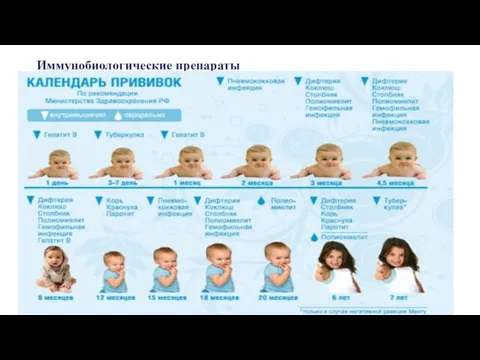
- 2. Иммунобиологические препараты Иммунопрофилактика – комплекс противоэпидемических мероприятий, направленный на предупреждение инфекционных болезней и осуществляемый путем иммунизации
- 3. Иммунобиологические препараты препараты, получаемые из живых и убитых микроорганизмов и микробных продуктов, используемых для специфической профилактики
- 4. Иммунобиологические препараты
- 5. Иммунобиологические препараты Общими требованиями к вакцинным препаратам являются: высокая иммуногенность; ареактогенность; безвредность; минимальное сенсибилизирующее действие.
- 6. Иммунобиологические препараты Основное назначение профилактических и лечебных иммунобиологических препаратов с учетом их патогенетического действия состоит в:
- 7. Иммунобиологические препараты производство современных вакцин сталкивается с ограничениями: не все патогенные микроорганизмы удается культивировать, поэтому для
- 8. В последнее десятилетие с развитием технологии рДНК появилась возможность создания нового поколения вакцин, не обладающих недостатками
- 9. Вакцины. Общая характеристика. Классификация Вакцины – обширный класс препаратов, несущих антигенные признаки одного или нескольких возбудителей
- 10. Компоненты вакцин протективные антигены сорбент, консервант, наполнитель, Стабилизатор, неспецифические примеси
- 11. Классификация вакцин
- 12. Характеристика основных групп вакцин Живые вакцины представляют иммунопрофилактические препараты, состоящие из наследственно измененных форм возбудителей инфекционных
- 13. Живые вакцины получают путем искусственного аттенуирования или отбирая естественные авирулентные штаммы, или с помощью генетической инженерии
- 14. Основное требование, предъявляемое к живым вакцинам - отсутствие в инокуляционном материале вирулентных микроорганизмов! Положительные стороны живых
- 15. Химические (субъединичные) вакцины создаются из антигенных компонентов, извлеченных из микробной клетки получают из растворимых дериватов микробной
- 16. Химические (субъединичные) вакцины Для создания химических вакцин необходимо знать: Локализацию антигенных детерминант Иммуногенные свойства антигенных детерминант
- 17. Химические (субъединичные) вакцины Химический синтез Определяют первичную структуру антигенных детерминант Приступают к их химическому синтезу Конструируют
- 18. Химические (субъединичные) вакцины Генно-инженерная технология синтез генов комплементарных кДНК и РНК вирусов, кодирующих выработку протективных антигенов;
- 19. Химические (субъединичные) вакцины Недостатки: По иммуногенности современные химические вакцины уступают живым и убитым вакцинам; Действие направлено
- 20. Химические (субъединичные) вакцины Для повышения иммуногенности химических вакцин применяют адъюванты, способствующие длительному циркулированию протективного антигена в
- 21. Химические (субъединичные) вакцины Протективные антигены иммунологически активные вещества, имеют различную химическую природу, способны при введении в
- 22. Химические (субъединичные) вакцины Этапы серийного производства химических вакцин: 1. Наработка биомассы клеток возбудителя. 2. Выделение протективного
- 23. Анатоксины препараты, полученные из бактериальных экзотоксинов, полностью лишенные токсических свойств под воздействием физических и химических факторов,
- 24. Анатоксины Детоксицирующие факторы: формальдегид, окислители – тиазиновые и фталеиновые красители, перекись водорода, аскорбиновая кислота. Депонирующие вещества:
- 25. Анатоксины Технологическая схема получения анатоксинов 1. подбор наиболее токсигенного штамма; 2. выбранный штамм культивируют на жидкой
- 26. Анатоксины Для обезвреживания токсинов применяют следующие методы: Длительное выдерживание (3–5 нед.) токсина в 0,3–0,5 % растворе
- 27. Анатоксины Полученный анатоксин вводят в организм вместе с адъювантами. Белковый антиген адсорбируют на геле алюминия гидроксида
- 28. Особенности получения бактериальных анатоксинов Установлены закономерности между морфологией и проявлением токсигенной активности штамма Clostridium tetani: большее
- 29. Особенности получения бактериальных анатоксинов Процесс детоксикации бактерийных токсинов протекает неравномерно. В течение первых 4 сут. отмечается
- 30. Особенности получения бактериальных анатоксинов Очистку бактериальных анатоксинов проводят методами: химическими (осаждение органическими растворителями, высаливание), физико-химическими (обработка
- 31. Ассоциированные вакцины Ассоциированными препаратами называют вакцины, состоящие из однородных антигенов – только из анатоксинов или только
- 32. Ассоциированные вакцины Процесс получения вакцины АКДС предусматривает получение каждого из входящих антигенов отдельно: суспензия коклюшных микробов,
- 33. Современные принципы конструирования вакцин субклеточные вакцины - из отдельных структур бактерий субъединичные вакцины – из отдельных
- 34. Современные принципы конструирования вакцин Выполненные в 70–80-х гг. научные исследования позволили разработать идеи, а в некоторых
- 35. Современные принципы конструирования вакцин Почему нужны современные вакцины? Применяемые в повседневной практике вакцины содержат некоторое количество
- 36. Вакцины из искусственных антигенов При создании вакцин из искусственных антигенов осуществляется синтез аналогов природных антигенных детерминант,
- 37. Вакцины из искусственных антигенов Практический процесс получения искусственных антигенов складывается из 3 звеньев: выделение биологически активного
- 38. Вакцины из искусственных антигенов Принципиальная новизна современного этапа конструирования вакцин: начато создание искусственных макромолекул, обладающих необходимыми
- 39. Вакцины из искусственных антигенов при получении вакцин из искусственных антигенов задача состоит в том, чтобы выявить
- 40. Вакцины из искусственных антигенов Преимущества синтетических антигенов: безопасность; химическая чистота; возможность синтеза в больших количествах; простоту
- 41. Рибосомальные вакцины рибосомальные (субклеточные) вакцины – препараты, состоящие из рибосом соответствующего возбудителя
- 42. Рибосомальные вакцины Преимущества рибосомальных вакцин: бактериальные рибосомы не обладают токсичностью для животных и малоактивными для человека;
- 43. Рибосомальные вакцины Этапы получения рибосомальных вакцин Накопление биомассы микроорганизмов. Разрушение бактериальных клеток (механическим способом или обработкой
- 44. Рибосомальные вакцины
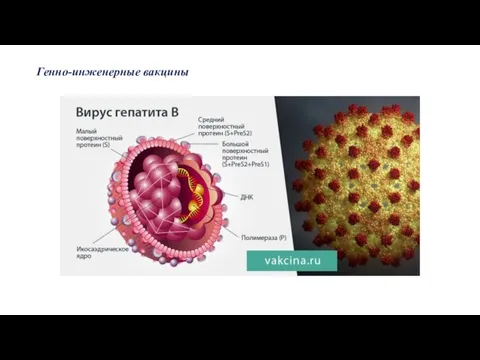
- 45. Генно-инженерные вакцины Генно-инженерные вакцины – препараты, полученные с применением рекомбинантных микроорганизмов Перспективность создания данного вида вакцин
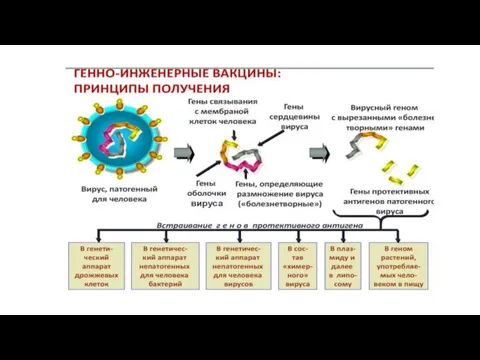
- 46. Генно-инженерные вакцины Стадии конструирования генно-инженерных вакцин Выделение или получение гена, кодирующего протективный антиген. Внесение гена в
- 47. Генно-инженерные вакцины
- 49. Векторные (рекомбинантные) вакцины Вакцина рекомбинантная – вакцина, изготовленная на основе штамма микроорганизма, в который методами генетического
- 50. Векторные (рекомбинантные) вакцины Преимущество: возможность вводить внутренний белок вируса, который образует комплекс с ДНК, который в
- 51. Векторные (рекомбинантные) вакцины получают методами генной инженерии: 1. гены вирулентного микроорганизма, отвечающий за синтез протективных антигенов,
- 52. Векторные (рекомбинантные) вакцины ДНК-вакцины обладают рядом преимуществ по сравнению с традиционными: 1. Способствуют выработке антител к
- 53. Векторные (рекомбинантные) вакцины ДНК-вакцины обладают рядом преимуществ по сравнению с традиционными: 2. Способствует выработке цитотоксических Т-лимфоцитов.
- 54. Векторные (рекомбинантные) вакцины ДНК-вакцины обладают рядом преимуществ по сравнению с традиционными: 3. Могут избирательно воздействовать на
- 56. Упрощение разработки и производства новых вакцин Простота получения ДНК патогенных микроорганизмов Возможность создания комбинированных вакцин Упрощение
- 57. Контроль качества вакцинных препаратов При разработке своих национальных требований к вакцинам все страны руководствуются рекомендациями ВОЗ.
- 58. Контроль качества вакцинных препаратов Технология и условия производства, качество вакцин определяются: производственными регламентами, техническими условиями, наставлениями
- 59. Контроль качества вакцинных препаратов В процессе производства контролируют: - нативную взвесь на стерильность, иммуногенность и густоту;
- 60. Контроль качества вакцинных препаратов Способность вакцин вызывать состояние невосприимчивости проверяют биологическим и эпидемиологическим способами.
- 61. Контроль качества вакцинных препаратов Общие требования: Безопасность Специфическая активность. Для обеспечения безопасности вакцин должны быть изучены
- 62. Контроль качества вакцинных препаратов Требованиями к специфической безопасности вакцин являются: полнота инактивации токсинов, бактерий, вирусов, отсутствие
- 63. Контроль качества вакцинных препаратов Специфическая активность вакцин включает показатели: количество антигена в единице объема, количество живых
- 65. Скачать презентацию


























































 Психоневрологические интернаты
Психоневрологические интернаты Инфекционные заболевания
Инфекционные заболевания Сэр Александр Флеминг. Пенициллин
Сэр Александр Флеминг. Пенициллин Донорство у тебя в крови
Донорство у тебя в крови Первая помощь
Первая помощь острые заболевания 2
острые заболевания 2 ДДСҰ денсаулықты қорғау және нығайту саласындағы бағдарламалары
ДДСҰ денсаулықты қорғау және нығайту саласындағы бағдарламалары Частная гистология
Частная гистология Профилактика внебольничных пневмоний. Профилактика педикулеза
Профилактика внебольничных пневмоний. Профилактика педикулеза _5_ повреждение глаза
_5_ повреждение глаза Переломы костей таза
Переломы костей таза Айткали Карина_легкие
Айткали Карина_легкие Врожденные пороки сердца у детей. Лекция
Врожденные пороки сердца у детей. Лекция Көмек көрсету деңгейіне сәйкес емдеуге жатқызу өлшемдері
Көмек көрсету деңгейіне сәйкес емдеуге жатқызу өлшемдері Задание в тестовой форме на тему Аритмии
Задание в тестовой форме на тему Аритмии 1 декабря - Всемирный день борьбы с ВИЧ/СПИДом
1 декабря - Всемирный день борьбы с ВИЧ/СПИДом Роль грибов в борьбе с онкологическими заболеваниями
Роль грибов в борьбе с онкологическими заболеваниями Адреналин – гормон активных действий
Адреналин – гормон активных действий Мифы о здоровом образе жизни
Мифы о здоровом образе жизни Реабилитация пациентов, перенёсших COVID-19 в стационаре Центра реабилитации
Реабилитация пациентов, перенёсших COVID-19 в стационаре Центра реабилитации Лечебная физкультура при заболеваниях гепатобилиарной системы
Лечебная физкультура при заболеваниях гепатобилиарной системы Виды ЗУА и способы компенсации нарушений слуха с помощью слухового аппарата
Виды ЗУА и способы компенсации нарушений слуха с помощью слухового аппарата Технология обработки пищевых продуктов
Технология обработки пищевых продуктов Зубные пасты...Их так много...Стоматология
Зубные пасты...Их так много...Стоматология Пороки сердца
Пороки сердца ПГПР +косметическое отбеливание
ПГПР +косметическое отбеливание Прямая офтальмоскопия
Прямая офтальмоскопия Рак молочной железы в Курской области: что изменилось
Рак молочной железы в Курской области: что изменилось