Содержание
- 2. Определения Фальсифицированное ЛС: лекарственное средство, сопровождаемое ложной информацией о его составе и (или) производителе Недоброкачественное ЛС:
- 3. Основные нормативные правовые акты Об основах охраны здоровья граждан в РФ: федеральный закон от 21.11.2011 №
- 4. Основные НД Об утверждении Правил уничтожения недоброкачественных лекарственных средств, фальсифицированных лекарственных средств и контрафактных лекарственных средств
- 5. Учебно-методические разработки кафедры Солонинина А.В., Шумиловских Е.В. Организация работы с непригодными для медицинского использования лекарственными средствами
- 6. Непригодные для медицинского использования ЛС, МИ Фальсифицированное ЛС –ЛС, сопровождаемое ложной информацией о его составе и
- 7. В ФЗ «Об обращении ЛС» вопросам качества ЛС посвящены следующие статьи: В ст. 47 говорится о
- 8. Основания и порядок уничтожения ЛС Гл. 11, ст. 59 ФЗ «Об обращении ЛС» Недоброкачественные ЛС, ФЛС
- 9. ФЗ от 31 декабря 2014 года N 532-ФЗ «О внесении изменений в отдельные законодательные акты РФ
- 10. ФЗ от 21.11.2011 № 323-ФЗ «ОБ ОСНОВАХ ОХРАНЫ ЗДОРОВЬЯ ГРАЖДАН В РФ» СТАТЬЯ 38. МЕДИЦИНСКИЕ ИЗДЕЛИЯ
- 11. ФЗ от 21.11.2011 № 323-ФЗ «ОБ ОСНОВАХ ОХРАНЫ ЗДОРОВЬЯ ГРАЖДАН В РФ» СТАТЬЯ 38. МЕДИЦИНСКИЕ ИЗДЕЛИЯ
- 12. ФЗ от 21.11.2011 № 323-ФЗ «ОБ ОСНОВАХ ОХРАНЫ ЗДОРОВЬЯ ГРАЖДАН В РФ» СТАТЬЯ 49. МЕДИЦИНСКИЕ ОТХОДЫ
- 13. КЛАССИФИКАЦИЯ МЕДИЦИНСКИХ ОТХОДОВ «Санитарно-эпидемиологические требования к обращению с медицинскими отходами. Санитарно-эпидемиологические правила и нормативы САНПИН 2.1.7.2790-10»
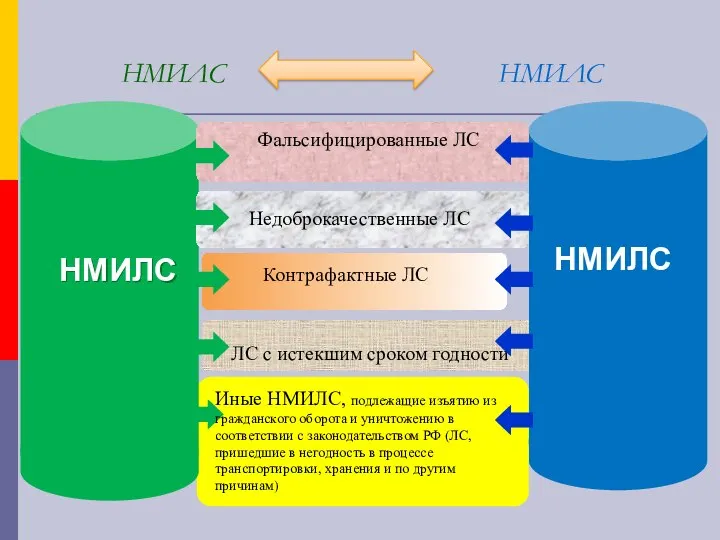
- 14. НМИЛС НМИЛС НМИЛС Недоброкачественные ЛС ЛС с истекшим сроком годности Фальсифицированные ЛС Контрафактные ЛС Иные НМИЛС,
- 15. Правила НАП ОБ УТВЕРЖДЕНИИ ПРАВИЛ НАДЛЕЖАЩЕЙ АПТЕЧНОЙ ПРАКТИКИ ЛП ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ (приказ Минздрава России от
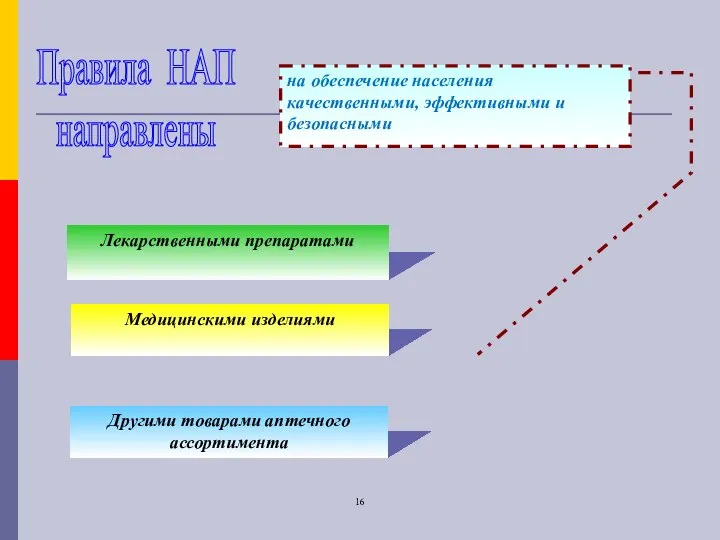
- 16. Правила НАП направлены на обеспечение населения качественными, эффективными и безопасными Лекарственными препаратами Медицинскими изделиями Другими товарами
- 17. Правила НАП устанавливают требования к осуществлению розничной торговли аптечными организациями ИП, имеющими лицензию на фармацевтическую деятельность
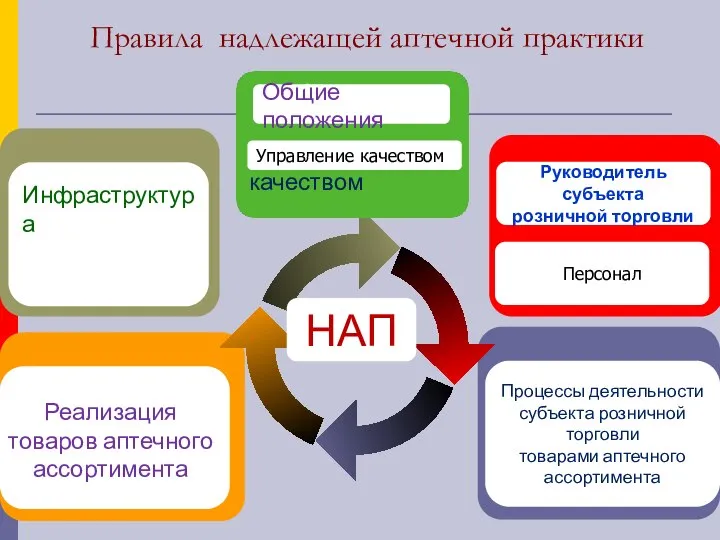
- 18. Правила надлежащей аптечной практики Инфраструктура Реализация товаров аптечного ассортимента Процессы деятельности субъекта розничной торговли товарами аптечного
- 19. Правила НАП Общие положения Управление качеством Руководитель субъекта розничной торговли Персонал Инфраструктура здания, рабочее пространство и
- 20. II. Управление качеством Розничная торговля товарами аптечного ассортимента осуществляется посредством реализации комплекса мероприятий, направленных на соблюдение
- 21. Правила НАП III. Руководитель субъекта розничной торговли 7. Руководитель субъекта розничной торговли обеспечивает: б) определение политики
- 22. Правила НАП. VIII. Проведение оценки деятельности 59. Руководитель субъекта розничной торговли проводит оценку деятельности с целью
- 23. В стандартных операционных процедурах должны быть описаны порядки: а) осуществления анализа жалоб и предложений покупателей и
- 24. 1
- 25. СИСТЕМА УПРАВЛЕНИЯ ДВИЖЕНИЕМ НЕПРИГОДНЫХ К МЕДИЦИНСКОМУ ИСПОЛЬЗОВАНИЮ ЛЕКАРСТВЕННЫХ СРЕДСТВ Система базируется на государственной политике по обеспечению
- 26. Участники Системы организации оптовой торговли ЛС, индивидуальные предприниматели, имеющие лицензию на фармацевтическую деятельность, аптечные организации, другие
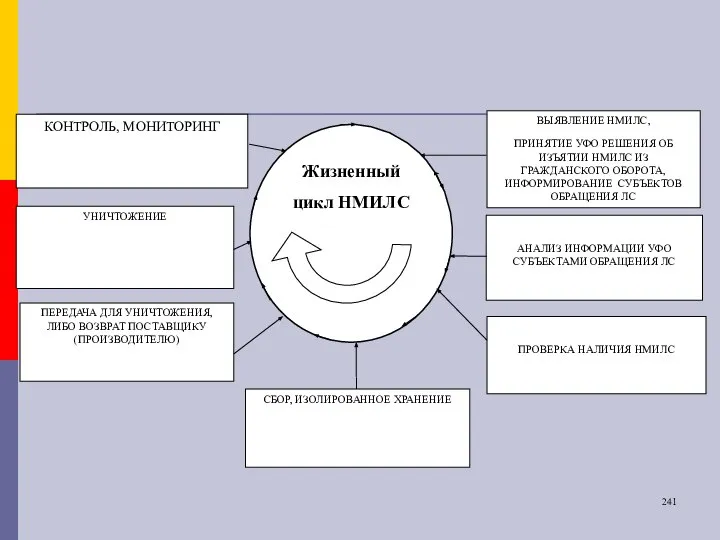
- 27. Основные процессы Системы выявление НМИЛС, принятие решения об изъятии НМИЛС из гражданского оборота, информирование субъектов обращения
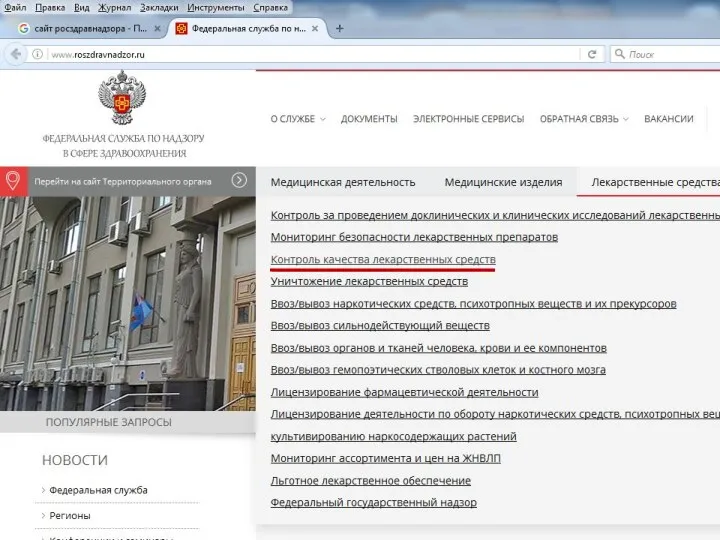
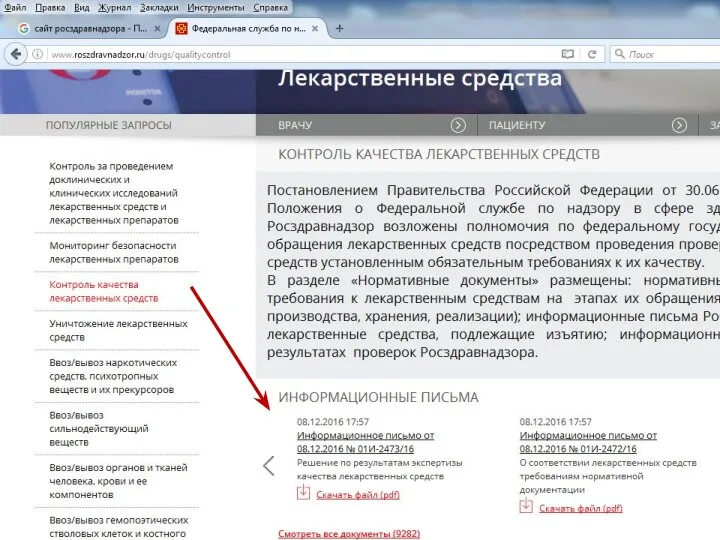
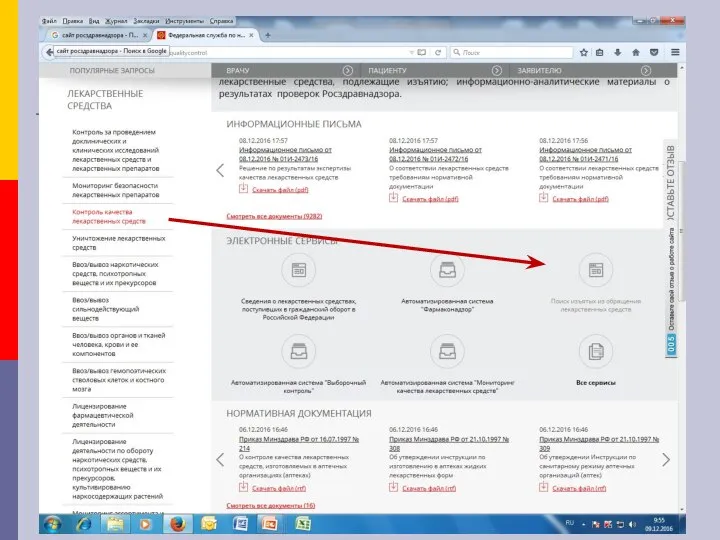
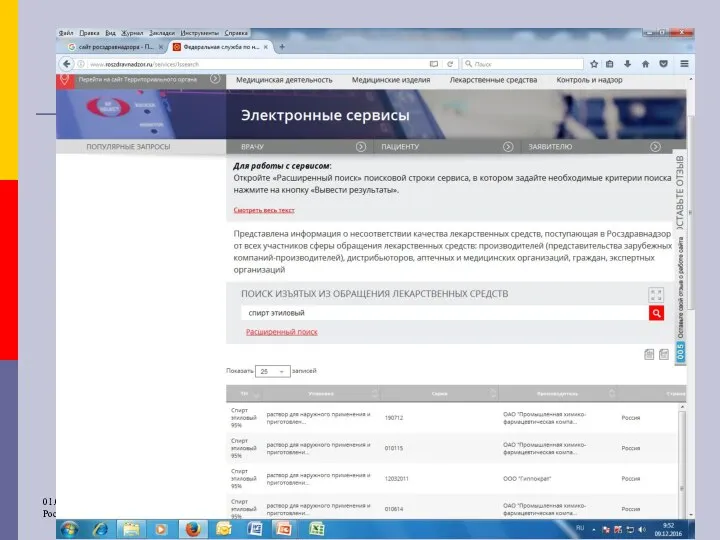
- 28. Информация о ФЛС, НЛС Информационные письма Росздравнадзора, обобщенную информацию о результатах проведенных проверок и решениях Росздравнадзора
- 29. 01.03.2017Тельнова Е.А. Росздравнадзор 1
- 30. 01.03.2017Тельнова Е.А. Росздравнадзор 1
- 31. Информация о ФЛС, НЛС Информационные письма Росздравнадзора, обобщенную информацию о результатах проведенных проверок и решениях Росздравнадзора
- 32. 01.03.2017Тельнова Е.А. Росздравнадзор 1
- 33. 01.03.2017Тельнова Е.А. Росздравнадзор 1
- 34. Функции участников Системы Владелец ЛС: - осуществляет анализ информации о выявленных НМИЛС; - проводит проверку наличия
- 35. Функции участников Системы Аптечная организация: - осуществляет анализ информации о выявленных НМИЛС; - проводит проверку наличия
- 36. Этапы выявления НМИЛС в аптечной организации При приемочном контроле В результате изучения информации на сайте Росздравнадзора,
- 37. Приемочный контроль Необходимо проверять на сайте Росздравнадзора каждую номенклатурную позицию ЛП в поисковой системе При выявлении
- 38. Анализ информации о выявленных НМИЛС руководителем организации из числа сотрудников организации назначается уполномоченное лицо, в обязанности
- 39. Проверка наличия НМИЛС 1 этап: документарная проверка поступления и реализации (отпуска) НМИЛС, по результатам которой оформляется
- 40. Выявление иных НМИЛС в результате внутреннего контроля Для выявления ЛС с истекшим сроком годности, а также
- 41. Сбор, изолированное хранение НМИЛС На основании распоряжения руководителя должностным лицом организации незамедлительно осуществляется оповещение покупателей, структурных
- 42. Передача НМИЛС для уничтожения (возврат поставщику/ владельцу/производителю Размещенные в помещении (зоне) изолированного хранения НМИЛС упаковываются, маркируются
- 43. Уничтожение НМИЛС Организация, осуществляющая уничтожение НМИЛС, принимает от владельца НМИЛС, организует их хранение, проводит сортировку НМИЛС,
- 44. Акт об уничтожении ЛС Акт об уничтожении ЛС составляется в день уничтожения НМИЛС, подписывается всеми лицами,
- 45. Контроль и мониторинг Контроль и мониторинг осуществляется УФО путем проведения плановых и внеплановых проверок наличия в
- 46. ДОКУМЕНТИРОВАНИЕ ПРОЦЕДУР Все действия организации по изъятию и передаче для уничтожения НМИЛС подлежат документированию Форма и
- 47. Перечень рекомендуемых документов для оформления движения НМИЛС Перечень (база данных) выявленных НМИЛС Акт документарной проверки для
- 49. Скачать презентацию






































 Рациональное питание в профилактике кариеса
Рациональное питание в профилактике кариеса торак1
торак1 Экзофтальм. Щитовидная железа
Экзофтальм. Щитовидная железа Устройство для чистки межзубных промежутков
Устройство для чистки межзубных промежутков Болезнь Менетрие (хронический гипертрофический полиаденоматозный гастрит)
Болезнь Менетрие (хронический гипертрофический полиаденоматозный гастрит) Внедрение доказательной медицины. Оценка результатов выполненной работы
Внедрение доказательной медицины. Оценка результатов выполненной работы Паразиты и гельминты. Глистные заболевания. Тема 10
Паразиты и гельминты. Глистные заболевания. Тема 10 Науқастың клиникалық жағдайда
Науқастың клиникалық жағдайда Цукровий діабет
Цукровий діабет Туберкулез вчера и сегодня
Туберкулез вчера и сегодня Гендік инженерия
Гендік инженерия Мышцы таза
Мышцы таза Дренирование гнойно-воспалительных процессов плеча
Дренирование гнойно-воспалительных процессов плеча Современные диуретические средства и их рациональные комбинации в лечении гипертонической болезни
Современные диуретические средства и их рациональные комбинации в лечении гипертонической болезни Жасушалық цикл
Жасушалық цикл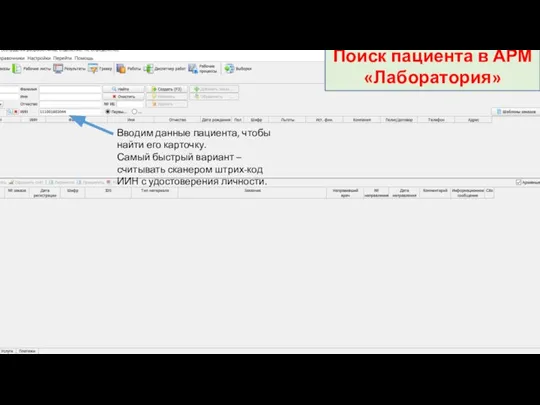 Инструкция по регистрации заказов. Поиск пациента в АРМ Лаборатория
Инструкция по регистрации заказов. Поиск пациента в АРМ Лаборатория Механизмы развития гипотермии
Механизмы развития гипотермии Жедел аппендициттің клиникасы
Жедел аппендициттің клиникасы Основы ИВЛ. Респираторная механика
Основы ИВЛ. Респираторная механика Биохимические особенности течения злокачественных процессов
Биохимические особенности течения злокачественных процессов Искусственный интеллект в медицине
Искусственный интеллект в медицине Хронический панкреатит
Хронический панкреатит Основные гериатрические синдромы
Основные гериатрические синдромы Базовая медицинская помощь новорождённому в родильном зале и в послеродовом отделении
Базовая медицинская помощь новорождённому в родильном зале и в послеродовом отделении Healthy food. Rainbow Diet
Healthy food. Rainbow Diet Травмы. Виды переломов
Травмы. Виды переломов Взятие мокроты на исследования
Взятие мокроты на исследования Гепатоцеребральная дистрофия
Гепатоцеребральная дистрофия