Цель урока: 1. Познакомить учащихся с физическими и химическими свойствами азотной кислоты как электролита. 2. Совершенствовать пр
Содержание
- 2. Разминка: А1. Степень окисления азота в азотной кислоте 1) +4 2) +5 3) +2 4) +3
- 3. Подготовка к Е Г Э А 2. По физическим свойствам азот и аммиак 1) газы 2)
- 4. Подготовка к ЕГЭ А 3. По числу атомов водорода азотная кислота( HNO3) 1) одноосновная 2) двухосновная
- 5. Подготовка к ЕГЭ А4. Протонов в ядре азота 1) 14 2) 28 3) 7 4) 2
- 6. Подготовка к ЕГЭ А5 . Вещество при диссоциации которого в водных растворах образуются катионы водорода и
- 7. Подготовка к Е Г Э В 1. Верны ли следующие суждения о аммиаке А. Аммиак хорошо
- 8. Физические свойства HNO3 1. Бесцветная жидкость с резким запахом. 2. Концентрированная азотная кислота(98% плотность1,51г/см3 )на воздухе
- 9. Классификация кислоты Азотная кислота: -одноосновная -кислородная -летучая -сильный электролит - растворима в воде
- 10. Получение кислоты 1.Азотная кислота известна человеку с 17 века. 2.Впервые ученый Глаубер получил кислоту из селитры,
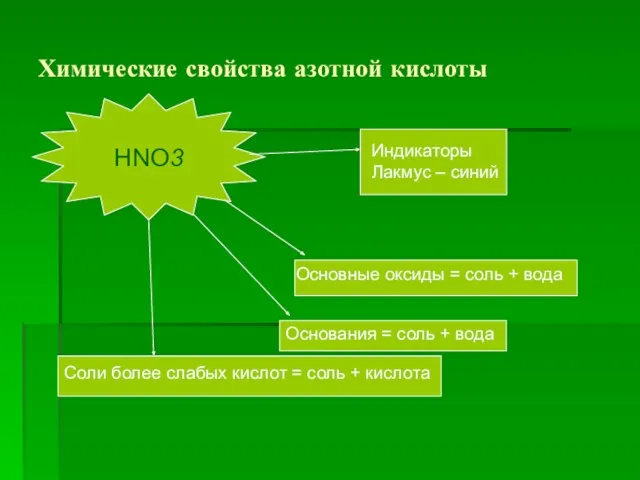
- 11. Химические свойства азотной кислоты HNO3 Основные оксиды = соль + вода Основания = соль + вода
- 12. Лабораторная работа «Характерные свойства азотной кислоты как электролита» Правила по ТБ. План работы: Опыт1. Взаимодействие кислоты
- 13. Специфические свойства азотной кислоты. 1.При нагревании и под действием света азотная кислота разлагается. 2. Со скипидаром
- 14. Специфические свойства
- 15. Воспламенение скипидара в концентрированной азотной кислоте.
- 16. Домашнее задание: §26 задача №4, стр. 44. вариант №4
- 18. Скачать презентацию














 Что такое сквернословие
Что такое сквернословие Цирк - вид зрелищного искусства
Цирк - вид зрелищного искусства Понятие вероятности
Понятие вероятности Объединение «Грамматландия» Составила: Мануйлова Н. В. 2011 г.
Объединение «Грамматландия» Составила: Мануйлова Н. В. 2011 г. Pikirsayys_kluby
Pikirsayys_kluby Урок 4:Построение правильных многоугольников. Цель урока: 1. Научиться строить правильные многоугольники с помощью циркуля и
Урок 4:Построение правильных многоугольников. Цель урока: 1. Научиться строить правильные многоугольники с помощью циркуля и 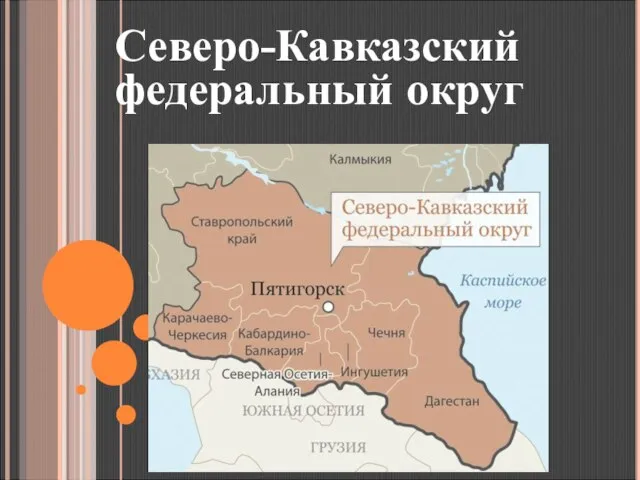 Презентация на тему Северо-Кавказский федеральный округ
Презентация на тему Северо-Кавказский федеральный округ  XXIII Бөлім. Жаһандық мәселелер: көші-қон саясаты
XXIII Бөлім. Жаһандық мәселелер: көші-қон саясаты Вопросы REACH и предприятий не ЕСк рассмотрениюМосква, 5 сентября 2007 г. Эта презентация не обязательно выражает официальное мне
Вопросы REACH и предприятий не ЕСк рассмотрениюМосква, 5 сентября 2007 г. Эта презентация не обязательно выражает официальное мне Экономика Москвы
Экономика Москвы  Презентация на тему Галерея великих математиков
Презентация на тему Галерея великих математиков POE_P05_cizi_kapital_rozvaha
POE_P05_cizi_kapital_rozvaha "ЭСТАФЕТА ДОБРА"
"ЭСТАФЕТА ДОБРА" Из истории Мягкой игрушки
Из истории Мягкой игрушки границы россии (2)
границы россии (2) Установление империи в Риме
Установление империи в Риме Колизей
Колизей Договор управления КМД между УО и собственными помещениями
Договор управления КМД между УО и собственными помещениями Взаимосвязь в команде Ты не один: 1+1
Взаимосвязь в команде Ты не один: 1+1 История Ирины Шишовой
История Ирины Шишовой Колумб Вселенной
Колумб Вселенной НА ПОРОГЕ ВЫБОРА
НА ПОРОГЕ ВЫБОРА История цифр и их связь с кодированием информации
История цифр и их связь с кодированием информации вкладка ЦОД РБ 25.10.2016 17_15_25
вкладка ЦОД РБ 25.10.2016 17_15_25 Международное гуманитарное право
Международное гуманитарное право Ультрамарин. Театр теней
Ультрамарин. Театр теней Органическая химия. Предельные углеводороды
Органическая химия. Предельные углеводороды СТЕКЛО
СТЕКЛО