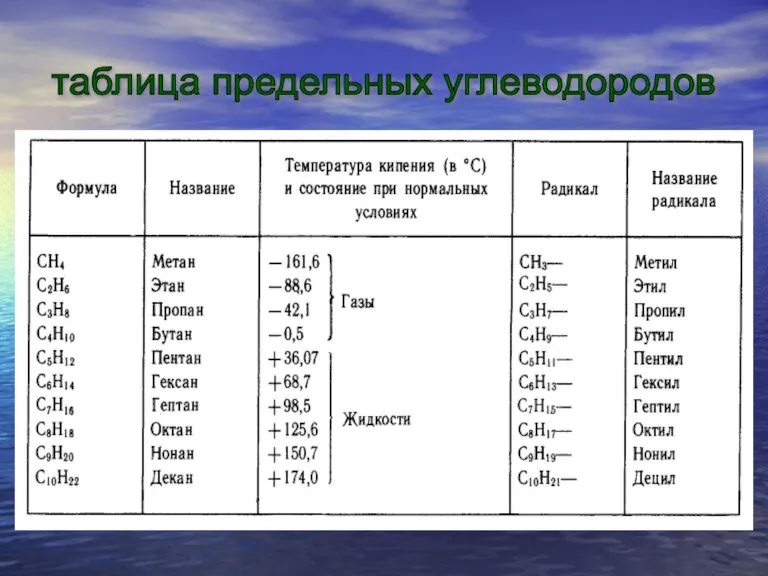
— сходный). В их молекулах имеются два, три, четыре и более атомов углерода. Каждый последующий углеводород отличается от предыдущего группой атомов СН2 (группу СН2 называют гомологической разностью).
гомологический ряд метана
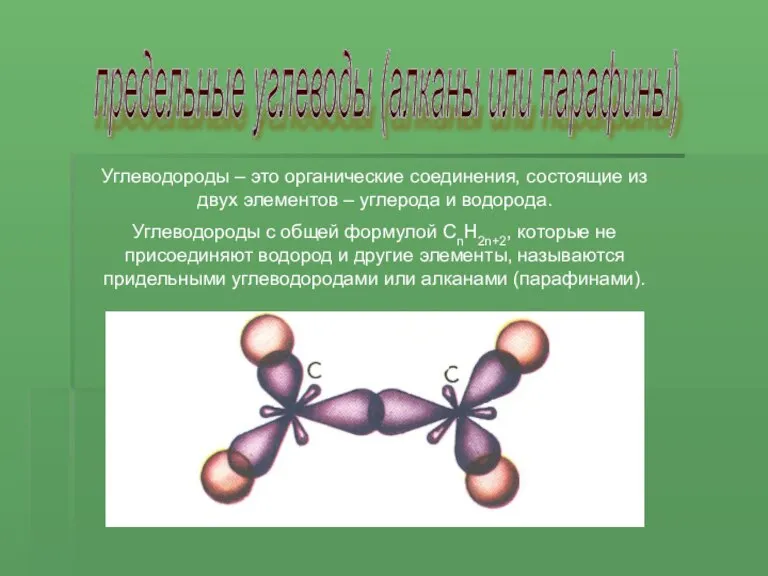
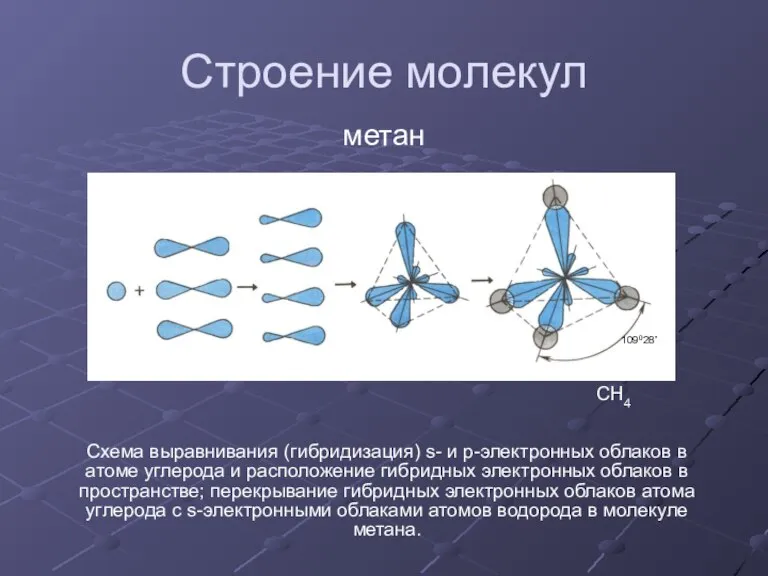
Электронное и пространственное строение других представителей предельных углеводородов сходно со строением молекулы метана.
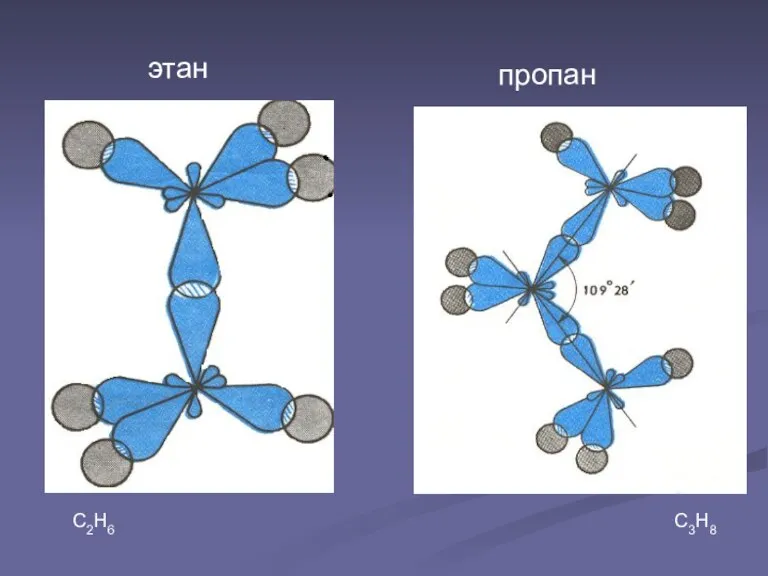
В молекуле этана С2Н6 химическая связь образуется между двумя атомами углерода перекрыванием двух гибридных электронных облаков.
Так как гибридные электронные облака атомов углерода направлены к вершинам тетраэдра, то при образовании молекулы пропана С3Н8 направление химической связи между вторым и третьим атомами углерода не может совпадать с направлением связи между первым и вторым атомами углерода. Образуется угол 109028'. Такие же углы существуют между четвертым, пятым и другими атомами углерода. Углеродная цепь поэтому принимает зигзагообразную форму.



 Пределы доказывания и бремя доказывания
Пределы доказывания и бремя доказывания ПОГОДА НЕПОГОДА ПОГОДНЫЙ О Е.
ПОГОДА НЕПОГОДА ПОГОДНЫЙ О Е. лапунов
лапунов Лингвистические основы вариативности перевода английских конструкций Complex Object на русский язык
Лингвистические основы вариативности перевода английских конструкций Complex Object на русский язык Презентация на тему Разминка по истории на тему Территории
Презентация на тему Разминка по истории на тему Территории  Презентация дисциплины по выбору «Информационная безопасность»
Презентация дисциплины по выбору «Информационная безопасность» «Хирургическая тактика при осложненных формах рака толстой кишки»
«Хирургическая тактика при осложненных формах рака толстой кишки» Ах, кошки!
Ах, кошки! Параолимпийские игры. Параолимпийцы
Параолимпийские игры. Параолимпийцы Отцово древо
Отцово древо АНГЛО-РУССКИЙ И ТОЛКОВЫЙ СЛОВАРИК КОМПЬЮТЕРНОЙ ТЕРМИНОЛОГИИ______________ 2D — привычная нам «плоская» двухмерная картинка. 3D — «трехме
АНГЛО-РУССКИЙ И ТОЛКОВЫЙ СЛОВАРИК КОМПЬЮТЕРНОЙ ТЕРМИНОЛОГИИ______________ 2D — привычная нам «плоская» двухмерная картинка. 3D — «трехме Японские школы
Японские школы Использование новых технологий в преподавании физики, информационных технологий
Использование новых технологий в преподавании физики, информационных технологий Лицензирование в туризме
Лицензирование в туризме На флейте Осени ТАЛЛИННСКИЙ БОТАНИЧЕСКИЙ САД TALLINNA BOTAANIKAAED
На флейте Осени ТАЛЛИННСКИЙ БОТАНИЧЕСКИЙ САД TALLINNA BOTAANIKAAED John Everett Millais
John Everett Millais  Как встречают Новый год
Как встречают Новый год ЛЕОНАРДО ДА ВИНЧИ
ЛЕОНАРДО ДА ВИНЧИ СОСТОЯНИЕ И ПЕРСПЕКТИВЫ БОЛГАРСКОЙ ЭКОНОМИКИ
СОСТОЯНИЕ И ПЕРСПЕКТИВЫ БОЛГАРСКОЙ ЭКОНОМИКИ Презентация на тему Наш великий могучий русский язык
Презентация на тему Наш великий могучий русский язык  Сертификация ИКТ-компетентности педагогических работников
Сертификация ИКТ-компетентности педагогических работников «Духовное единство народа и объединяющие нас моральные ценности — это такой же важный фактор развития, как политическая и экономи
«Духовное единство народа и объединяющие нас моральные ценности — это такой же важный фактор развития, как политическая и экономи Дорогая моя столица, Золотая моя Москва!
Дорогая моя столица, Золотая моя Москва! Переходный возраст
Переходный возраст Радиация и её воздействие на человека
Радиация и её воздействие на человека Philosophy
Philosophy  Презентация на тему Слезки березы
Презентация на тему Слезки березы Great Britain: England and Scotland
Great Britain: England and Scotland