Содержание
- 2. Оқу мақсаттары: - бірінші 20 элементтің электрондар санын атай білу - атомдағы электрондардың ядродан арақашықтықтары алыстай
- 3. Қайталау сұрақтары Атом деген не? Атом құрылысын сипаттаңыздар. Протон деген не? Нейтрон жайлы не білесіздер? Электронның
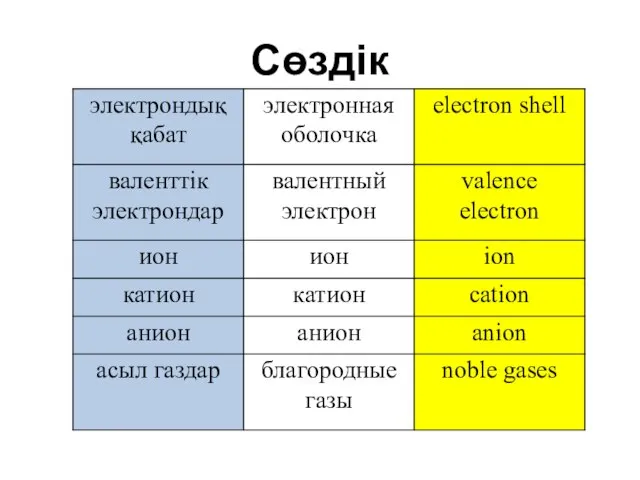
- 4. Сөздік
- 5. Атом деген не? https://twig-bilim.kz/kz/film/what-is-an-atom
- 6. Атом – күрделі бөлшек. Оның ортасында оң зарядты ядро орналасқан, ал оны теріс зарядты электрондар айналып
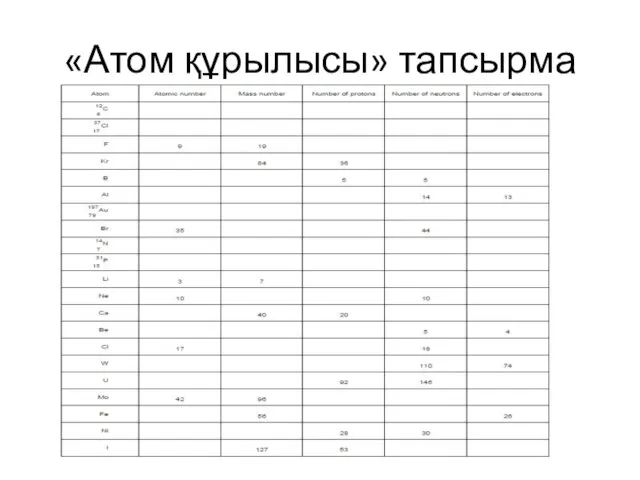
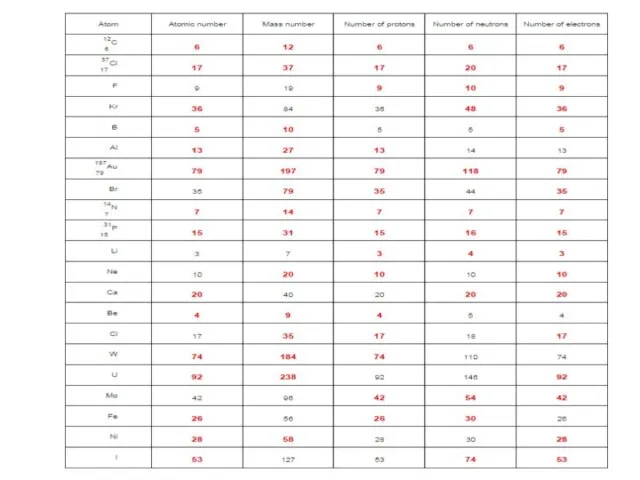
- 7. «Атом құрылысы» тапсырма
- 9. Электрондық бұлт Атомдағы электрондар қозғалысының траекториясы белгісіз, электрондар болу ықтималдығын – электрондық бұлт , ядро маңындағы
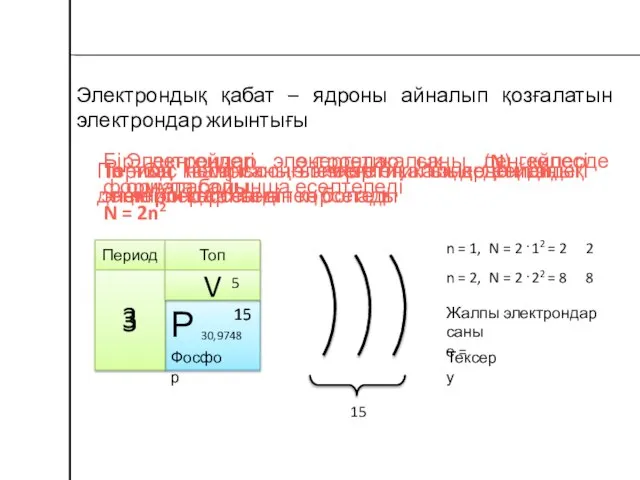
- 10. Электрондық қабат деп бір энергетикалық деңгейдегі электрондардың жиынтығын айтады.
- 11. «Электрондық қабат» https://twig-bilim.kz/kz/film/atom-structure-electron-shells
- 12. Электрондар ядроның айналасында, электрондық қабат деп те аталатын, белгілі бір энергетикалық деңгейлерде жоғары жылдамдықпен қозғалады. Жеке
- 13. Тапсырма Мына элементтерді электрон қабат саны қанша? He,Be, Si, Ca
- 14. He – 1 себебі периодтық кестеде бірінші периодта орналасқан Be – 2 себебі периодтық кестеде екінші
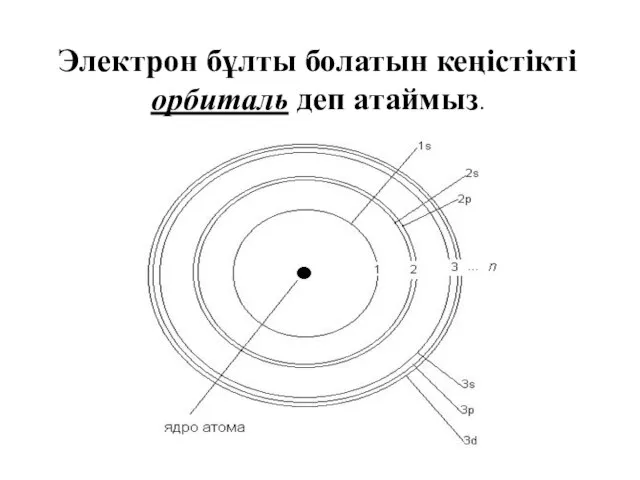
- 15. Электрон бұлты болатын кеңістікті орбиталь деп атаймыз.
- 16. Электрондық қауыз Атомның барлық электрондары жиналып электрондық қауызын құрайды. Өзара энергиясы жуық электрондар атомның электрондық қабатын
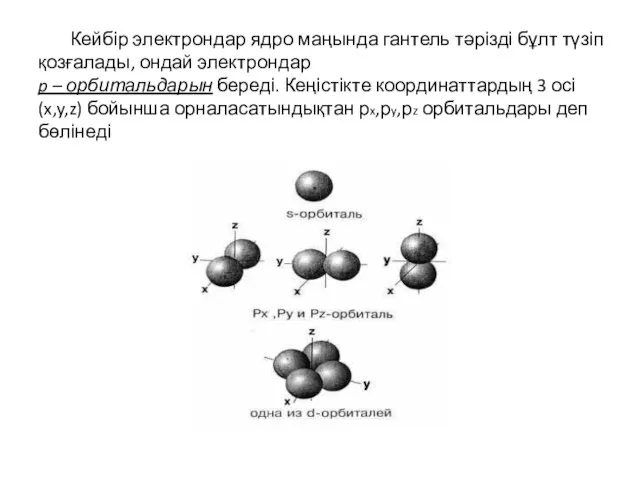
- 17. Кейбір электрондар ядро маңында гантель тәрізді бұлт түзіп қозғалады, ондай электрондар p – орбитальдарын береді. Кеңістікте
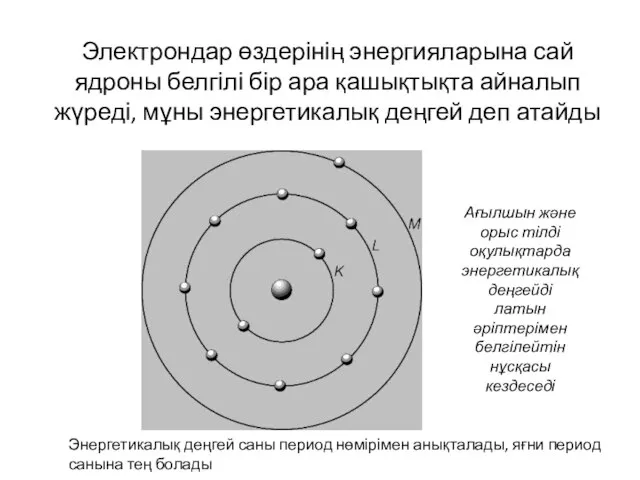
- 18. Электрондар өздерінің энергияларына сай ядроны белгілі бір ара қашықтықта айналып жүреді, мұны энергетикалық деңгей деп атайды
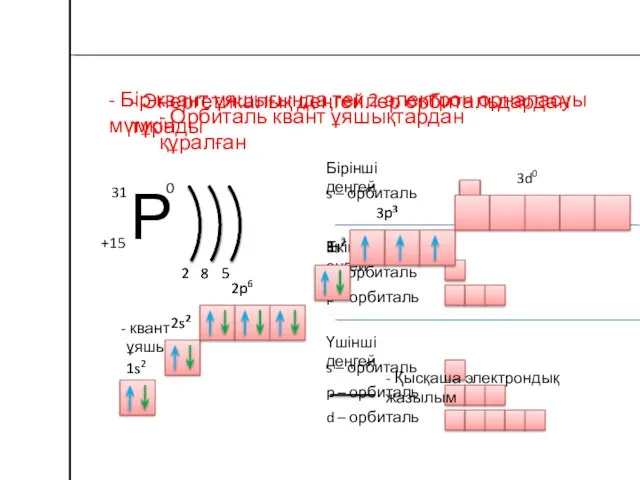
- 19. Электрондық қабат – ядроны айналып қозғалатын электрондар жиынтығы Электрондар энергетикалық деңгейлерде орналасады n – бас квант
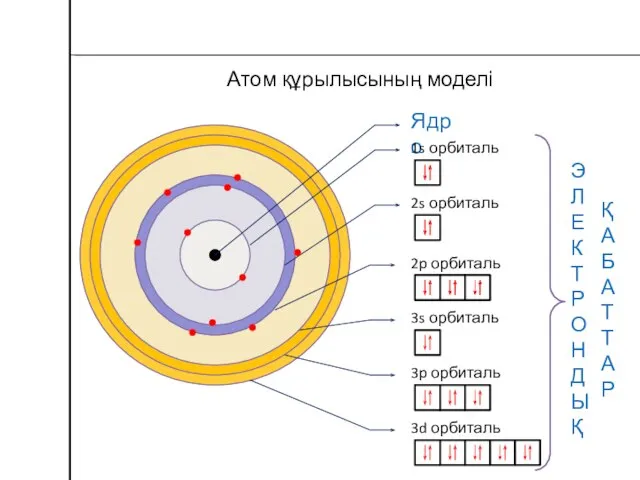
- 20. Атом құрылысының моделі Ядро 1s орбиталь 2s орбиталь 2p орбиталь 3s орбиталь 3p орбиталь 3d орбиталь
- 21. - Энергетикалық деңгейлер орбитальдардан тұрады 2 8 5 Бірінші деңгей s – орбиталь Екінші еңгей s
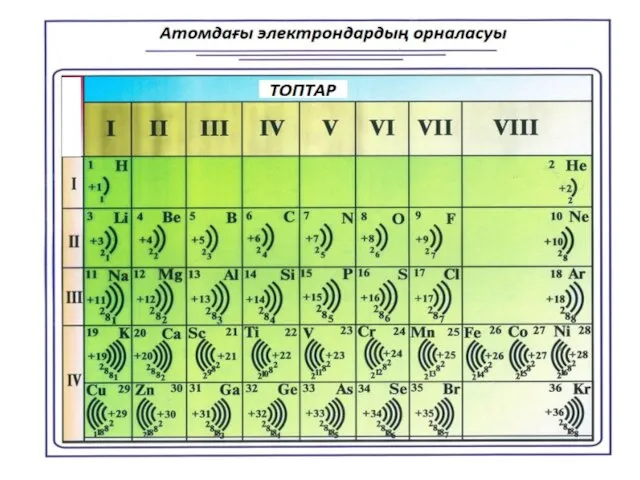
- 22. Периодтың нөмірі - энергетикалық деңгейлер (электрондық қабат) санына тең Бір энергетикалық деңгейдегі максималды электрондар саны N
- 23. Тапсырма Таңдап алған элементтеріңіздің электрондық қабатты көрсете отырып, атом үлгілерінің сызбаларын салуыңыздар Li,Na,K,Ca,Be,B,F,O,N,C,Si,P,Mg,S, Al, He,Ne,CI,Ar,H
- 25. Металдық және бейметалдық қасиеттер Периодтар мен топтарда металдық және бейметалдық қасиеттердің периодты түрде өзгереді. Жоғарыдан төменге
- 26. Атомдар инертті газдардың конфигурациясына ие болып тұрақтану үшін сыртқы қабаттағы электрондардарын беріп жіберіп немес соның үстіне
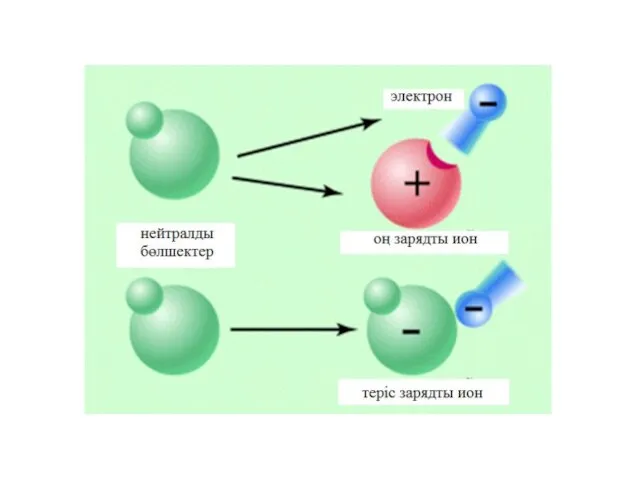
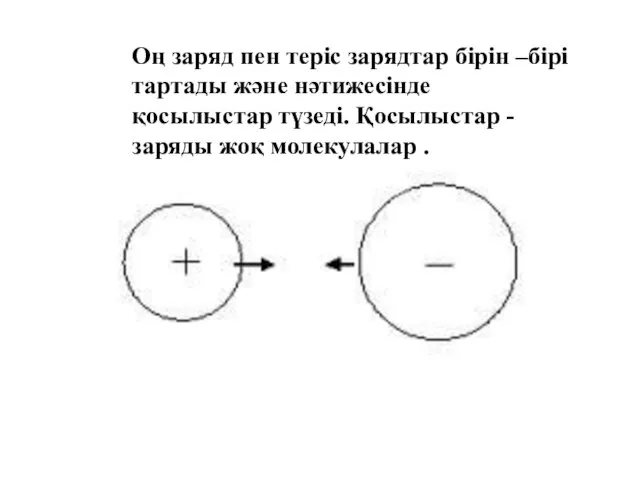
- 28. Оң заряд пен теріс зарядтар бірін –бірі тартады және нәтижесінде қосылыстар түзеді. Қосылыстар - заряды жоқ
- 29. Видео Иондар түзілуі https://www.youtube.com/watch?v=7BF4prQUymk
- 30. Төрт электронмен алмасу – максималды болып табылады
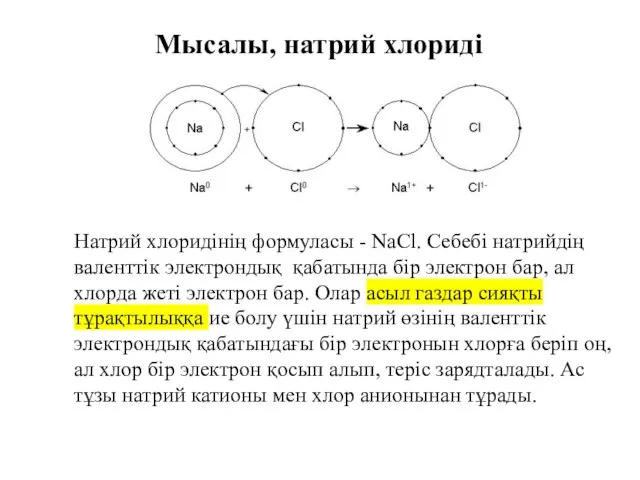
- 31. Мысалы, натрий хлориді Натрий хлоридінің формуласы - NaCl. Ceбебі натрийдің валенттік электрондық қабатында бір электрон бар,
- 32. Асыл газдар https://bilimland.kz/ru/courses/chemistry-ru/neorganicheskaya-ximiya/ehlementy-i-ix-soedineniya/lesson/inertnye-gazy
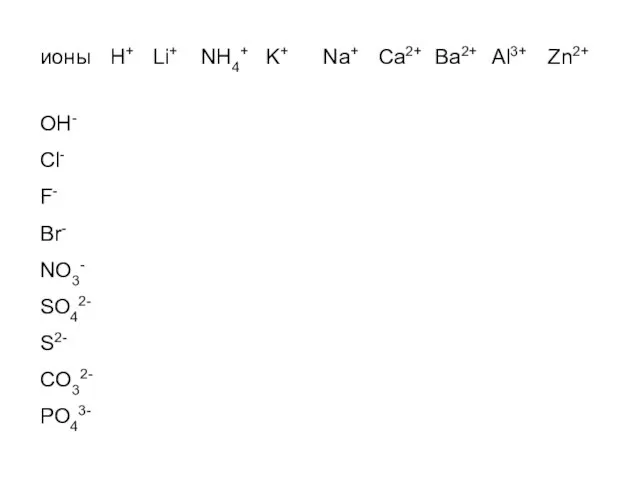
- 33. Бинарлы заттардың формулаларын құрастыру: 1.Затты құрайтын элементтердің таңбаларын бір қатарға жазамыз: мысалы, NaO + 2- 2.Химиялық
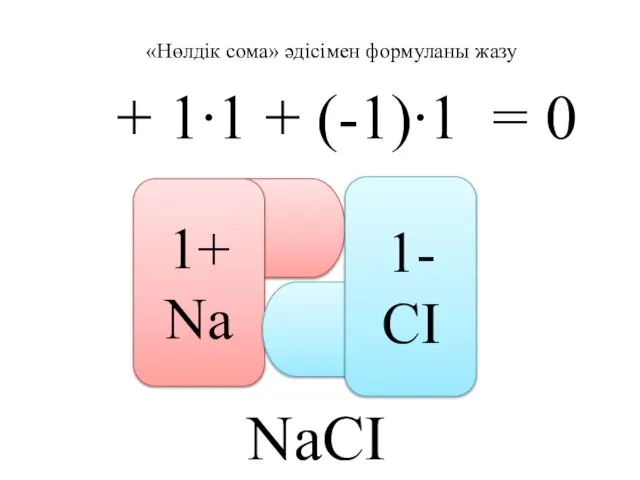
- 34. «Нөлдік сома» әдісімен формуланы жазу + 1∙1 + (-1)∙1 = 0 1+ Na 1- CI NaCI
- 35. Тұрмыста кездесетін заттардың формулалары
- 36. NaCl ас тұзы
- 37. су
- 38. С12Н22О11
- 39. Көмірқышқыл газы
- 40. SiO2 Құм
- 41. (C6H10O5)n
- 42. Негізгі терминдер Химиялық формула – химиялық жеке заттар молекуласының құрамын химиялық таңба және сан арқылы белгілеу.
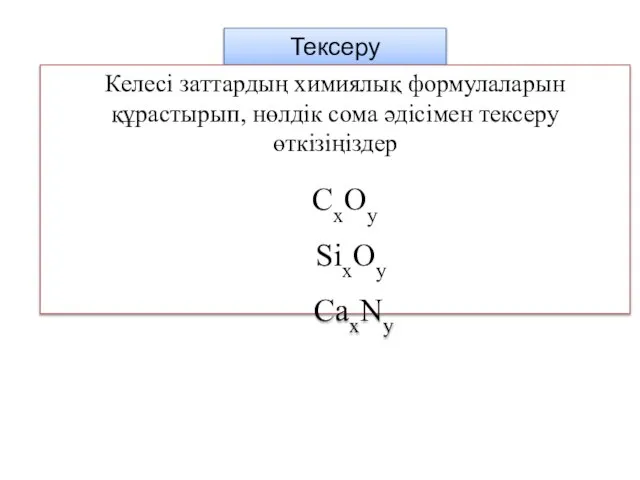
- 43. Тексеру Келесі заттардың химиялық формулаларын құрастырып, нөлдік сома әдісімен тексеру өткізіңіздер CxOy SixOy CaxNy
- 44. Бірінші қосынды - Al O
- 45. Екінші қосынды – NaH
- 46. Үшінші қосынды – CaN
- 47. Төртінші қосынды – HS
- 48. Бесінші қосынды – LiN
- 49. Алтыншы қосынды – SiO
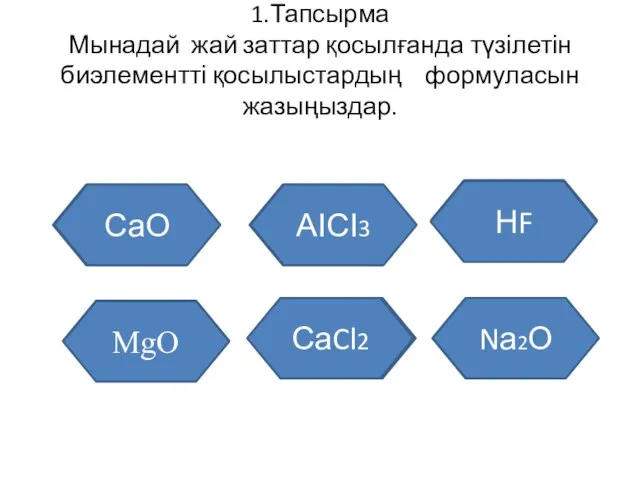
- 50. 1.Тапсырма Мынадай жай заттар қосылғанда түзілетін биэлементті қосылыстардың формуласын жазыңыздар. Кальций мен оттек Алюминий мен хлор
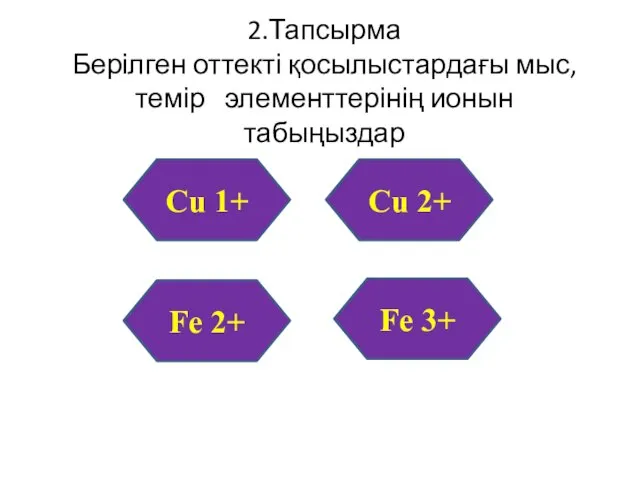
- 51. 2.Тапсырма Берілген оттекті қосылыстардағы мыс, темір элементтерінің ионын табыңыздар Сu2O СuO FeO Fe2O3 Сu 1+ Сu
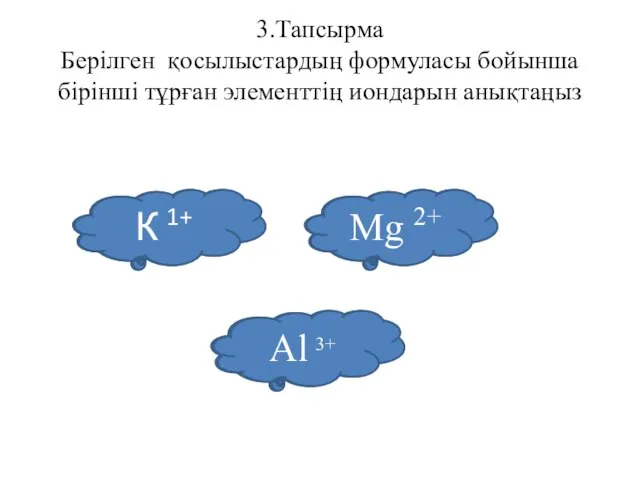
- 52. 3.Тапсырма Берілген қосылыстардың формуласы бойынша бірінші тұрған элементтің иондарын анықтаңыз КСІ MgСІ2 Al2S3 К 1+ Mg
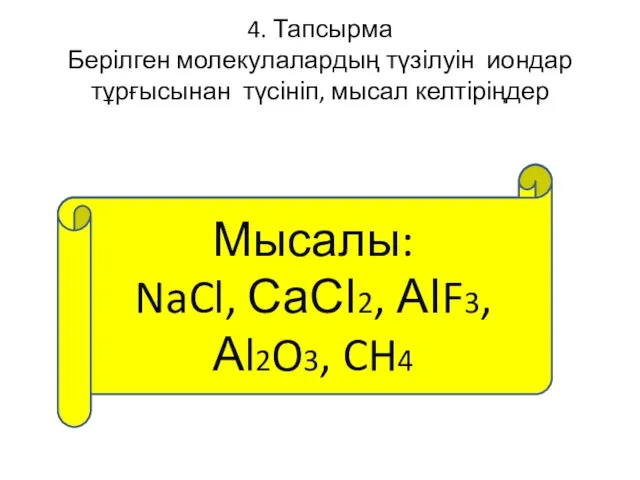
- 53. 4. Тапсырма Берілген молекулалардың түзілуін иондар тұрғысынан түсініп, мысал келтіріңдер АВ, АВ2, АВ3, А2В3, АВ4 Мысалы:
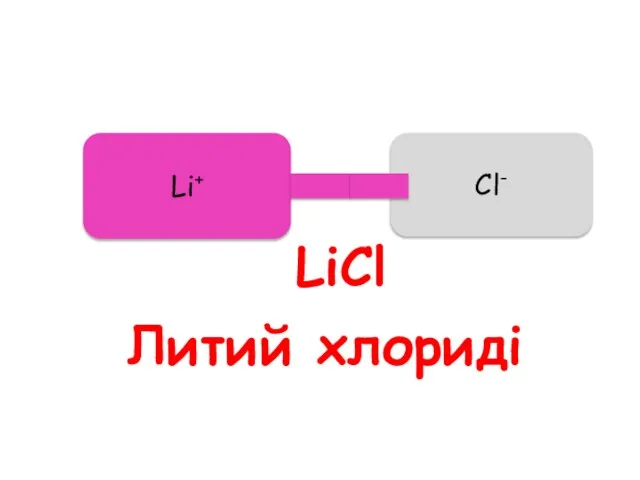
- 54. Литий хлориді Li+ Cl- LiCl
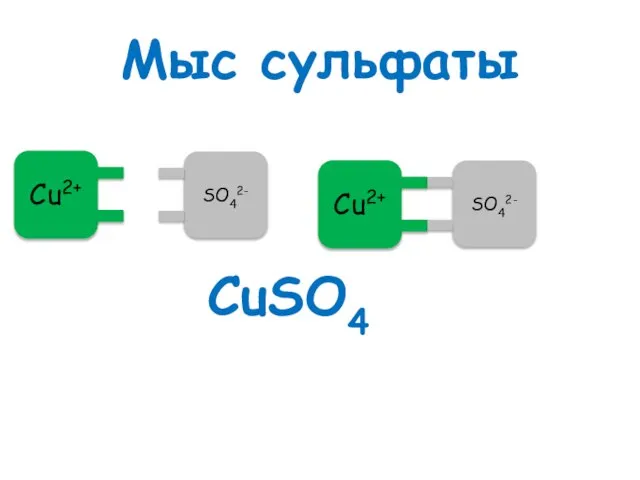
- 55. Мыс сульфаты CuSO4
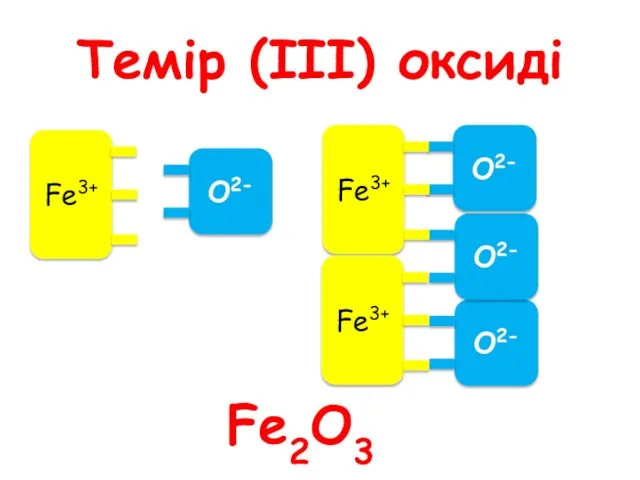
- 56. Темір (ІІІ) оксиді Fe2O3
- 58. Үй тапсырмасы Өтілген тақырыпты қайталау
- 59. Массалық үлес
- 60. Ойланыңыз өзіңіздің бөлмеңіз үйдің барлық ауданының қанша үлесін алып жатқандығын есептеңіз. Бұл алгоритмді күрделі қосылыстардың құрамына
- 61. Массалық үлес формуласы k – осы элементтің молекуладағы атомдар саны.
- 62. Су құрамындағы атомдар
- 64. Скачать презентацию





































 Виды сказуемых
Виды сказуемых Роль цвета в формотворчестве
Роль цвета в формотворчестве Acrobatic ROCK-N-ROLL
Acrobatic ROCK-N-ROLL СОЗДАНИЕ МУЛЬТИМЕДИЙНЫХ ПРЕЗЕНТАЦИЙ
СОЗДАНИЕ МУЛЬТИМЕДИЙНЫХ ПРЕЗЕНТАЦИЙ Попробуйте определить город Европейского Севера по его гербу, плану и фотографиям
Попробуйте определить город Европейского Севера по его гербу, плану и фотографиям Живопись в XVII в России
Живопись в XVII в России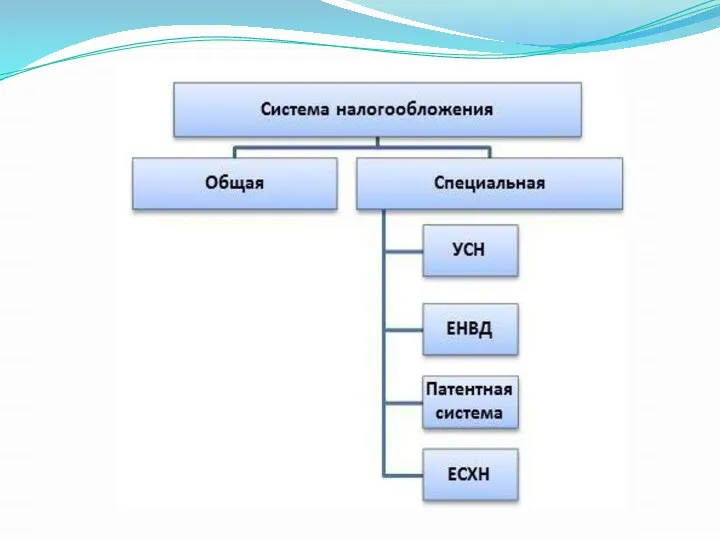 Система налогообложения
Система налогообложения Здоровые зубы как один из показателей здорового образа жизни
Здоровые зубы как один из показателей здорового образа жизни Мир верх ногами
Мир верх ногами Александр Невский
Александр Невский Сложение с числом ноль
Сложение с числом ноль Сущность менеджмента
Сущность менеджмента Родственно-контрастные сочетания
Родственно-контрастные сочетания Метательный и пневматический тир
Метательный и пневматический тир Тип Круглые червиВид Аскарида человеческая
Тип Круглые червиВид Аскарида человеческая ТМ Раптор Сроки проведения: 25 апреля – 25 мая 2012 г. Участники: оптовые клиенты нашего сайта Механика ТМ РАПТОР: за заказ акционной ма
ТМ Раптор Сроки проведения: 25 апреля – 25 мая 2012 г. Участники: оптовые клиенты нашего сайта Механика ТМ РАПТОР: за заказ акционной ма Белорусский государственный университетхимический факультетМагистерская диссертация на тему:Электрохимическое формировани
Белорусский государственный университетхимический факультетМагистерская диссертация на тему:Электрохимическое формировани Лекарство от стресса
Лекарство от стресса Учебная техника
Учебная техника Презентация на тему Тунгусский метеорит
Презентация на тему Тунгусский метеорит  Контраст тёмного и светлого пятна
Контраст тёмного и светлого пятна Loisirs. Le lexique
Loisirs. Le lexique «СОЗДАНИЕ И ВНЕДРЕНИЕ В ПРАКТИКУ ПРЕПОДАВАНИЯ СИСТЕМЫ ЦЕННОСТНО-ОРИЕНТИРОВАННЫХ ЭЛЕКТИВНЫХ КУРСОВ НА ОСНОВЕ КУЛЬТУРОЛОГИЧЕСКОГ
«СОЗДАНИЕ И ВНЕДРЕНИЕ В ПРАКТИКУ ПРЕПОДАВАНИЯ СИСТЕМЫ ЦЕННОСТНО-ОРИЕНТИРОВАННЫХ ЭЛЕКТИВНЫХ КУРСОВ НА ОСНОВЕ КУЛЬТУРОЛОГИЧЕСКОГ Метан и его свойства
Метан и его свойства НФ ДЕОЦ. Учебный филиал Отрадненский
НФ ДЕОЦ. Учебный филиал Отрадненский Светофорик приглашает
Светофорик приглашает Мясные блюда и полуфабрикаты
Мясные блюда и полуфабрикаты Страхование экологических рисков
Страхование экологических рисков