Содержание
- 2. ПЛАН. ОпределениеОпределение. Определение. Общая формула класса углеводородовОпределение. Общая формула класса углеводородов. Гомологический рядряд. Виды изомерии. Номенклатура
- 3. АЛКАНЫ. (ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ. ПАРАФИНЫ. НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ.) Алканы - углеводороды в молекулах которых все атомы углерода связаны
- 4. ГОМОЛОГИЧЕСКИЙ РЯД МЕТАНА СН4 метан С2H6 этан C3H8 пропан C4H10 бутан C5H12 пентан C6H14 гексан C7H16
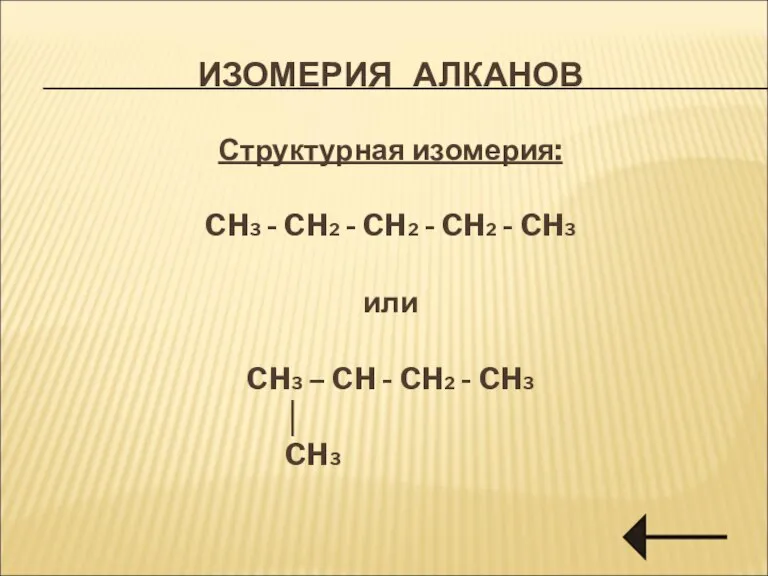
- 5. ИЗОМЕРИЯ АЛКАНОВ Структурная изомерия: CH3 - CH2 - CH2 - CH2 - CH3 или CH3 –
- 6. НОМЕНКЛАТУРА АЛКАНОВ Алгоритм. Выбор главной цепи: CH3 – CH - CH2 - CH3 │ CH3
- 7. НОМЕНКЛАТУРА АЛКАНОВ 2. Нумерация атомов главной цепи: 1 2 3 4 CH3 – CH - CH2
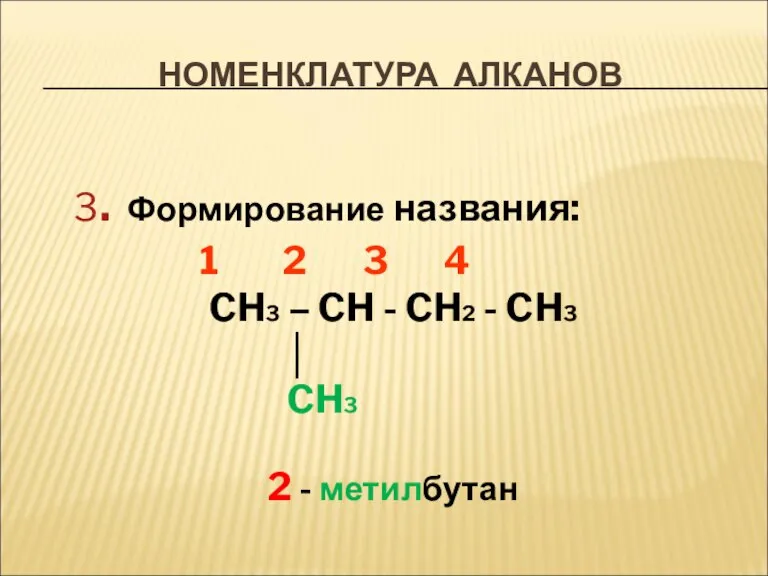
- 8. НОМЕНКЛАТУРА АЛКАНОВ 3. Формирование названия: 1 2 3 4 CH3 – CH - CH2 - CH3
- 9. РАДИКАЛ – ЭТО ЧАСТИЦА, ИМЕЮЩАЯ НЕСПАРЕННЫЕ ЭЛЕКТРОНЫ.
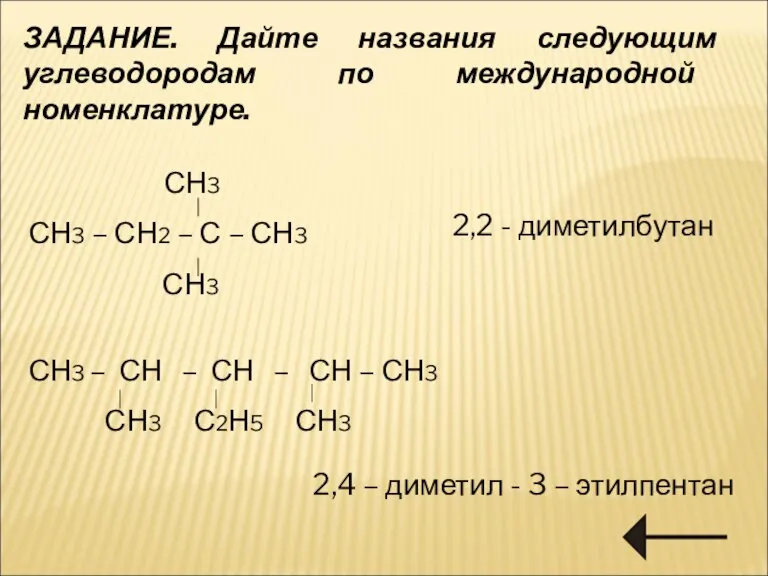
- 10. ЗАДАНИЕ. Дайте названия следующим углеводородам по международной номенклатуре. СН3 СН3 – СН2 – С – СН3
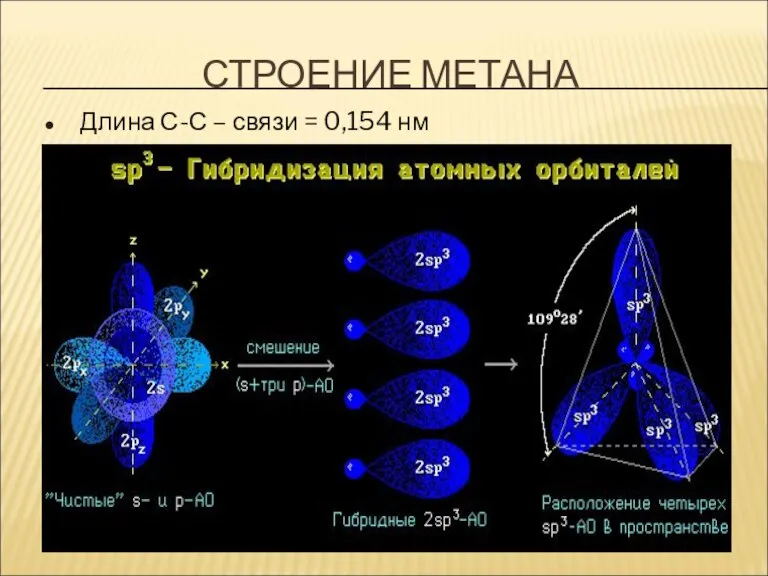
- 11. СТРОЕНИЕ МЕТАНА Длина С-С – связи = 0,154 нм
- 12. СТРОЕНИЕ МЕТАНА
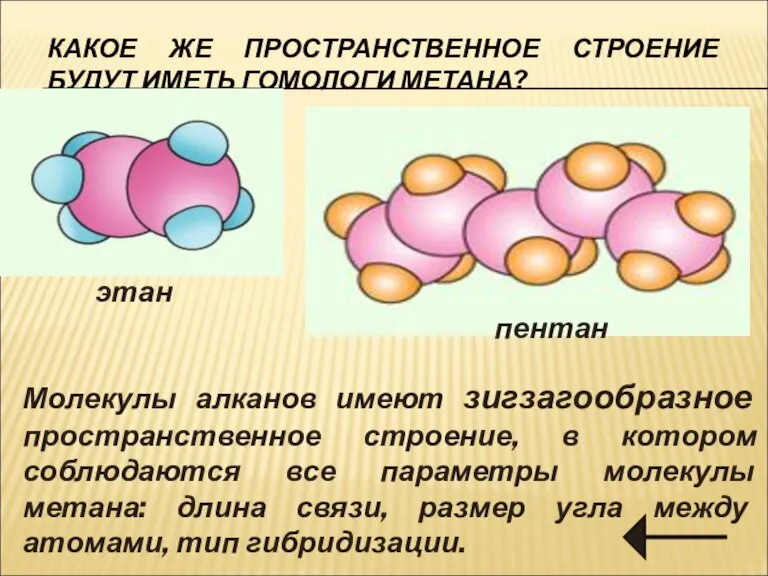
- 13. КАКОЕ ЖЕ ПРОСТРАНСТВЕННОЕ СТРОЕНИЕ БУДУТ ИМЕТЬ ГОМОЛОГИ МЕТАНА? этан пентан Молекулы алканов имеют зигзагообразное пространственное строение,
- 14. ФИЗИЧЕСКИЕ СВОЙСТВА С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.
- 15. Получение алканов 1 –выделение углеводородов из природного сырья 2- гидрирование циклоалканов и непредельных углеводородов 3- декарбоксилирование
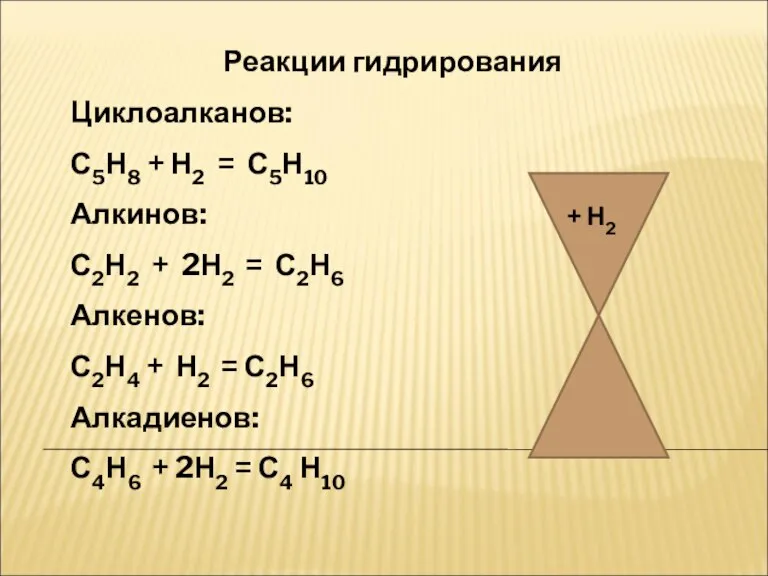
- 16. Реакции гидрирования Циклоалканов: С5Н8 + Н2 = С5Н10 Алкинов: С2Н2 + 2Н2 = С2Н6 Алкенов: С2Н4
- 17. Получение метана при сплавлении ацетата натрия со щелочью: t °C CH3COONa + NaOH ⎯⎯→ CH4 ⇑
- 18. Синтез Вюрца проводят с целью получения алканов с более длинной углеродной цепью. Например: получение этана из
- 19. Метан в лаборатории можно получить гидролизом карбида алюминия Al4C3 + 12H2O = 4Al(OH)3 + 3CH4
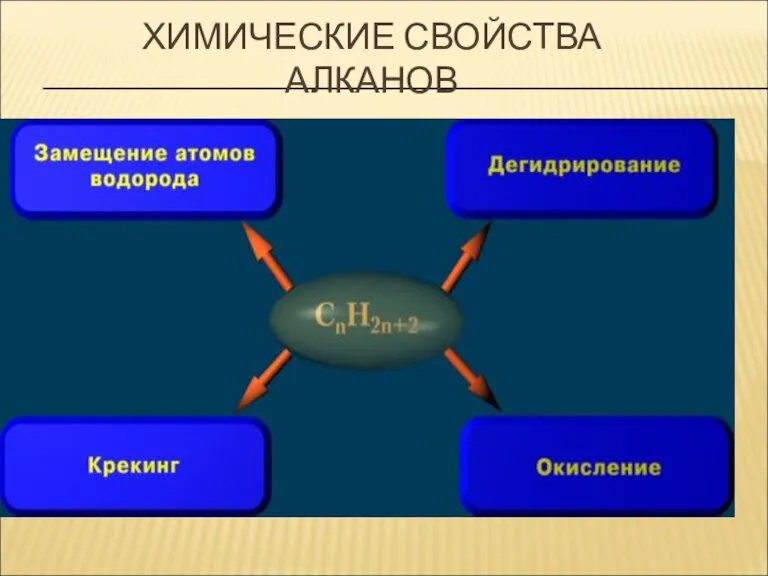
- 20. ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ
- 21. СН4 + Сl2 CH3Cl + HCl + Q t Реакции протекают по радикальному механизму. С Н
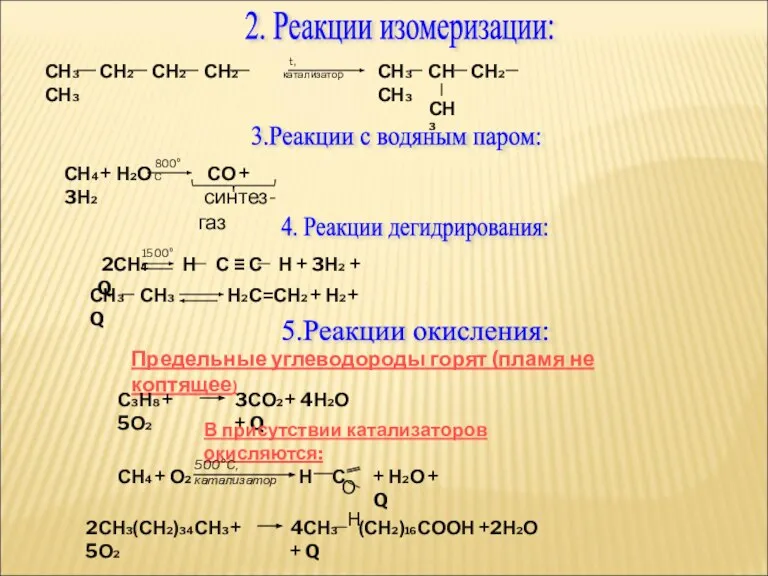
- 22. 2. Реакции изомеризации: СН3 СН2 СН2 СН2 СН3 t, катализатор СН3 СН СН2 СН3 СН3 3.Реакции
- 23. 6. РЕАКЦИЯ ГОРЕНИЯ: CH4 + 2O2 → CO2 + 2H2O + Q
- 24. Применение Получение ацетилена Горючее для дизельных и турбореактивных двигателей Получение растворителей В металлургии А также сырьё
- 25. ПРИМЕНЕНИЕ АЛКАНОВ 1-3 – производство сажи (1 – картрижи; 2 – резина; 3 – типографическая краска)
- 26. Проверка знаний Какие углеводороды относят к алканам? Запишите формулы возможных изомеров гексана и назовите их по
- 28. Скачать презентацию
















 Договор строительного подряда. _
Договор строительного подряда. _ Михаил Крючков Руководитель отдела казначейских и дилинговых операций, Компания «Диасофт» Учет фьючерсов и опционов 29 марта 2006 го
Михаил Крючков Руководитель отдела казначейских и дилинговых операций, Компания «Диасофт» Учет фьючерсов и опционов 29 марта 2006 го Ценные бумаги
Ценные бумаги Извитость и истинная длина шерсти
Извитость и истинная длина шерсти Структура и функции липопротеинов
Структура и функции липопротеинов  Похитители и сыщики. Игра
Похитители и сыщики. Игра Ваши способности в вашей власти.
Ваши способности в вашей власти. Christmas in Ukraine
Christmas in Ukraine  Hose Expert
Hose Expert Общий приём сложения однозначных чисел с переходом через десяток
Общий приём сложения однозначных чисел с переходом через десяток Предложения об изменении системы образования в основной школе
Предложения об изменении системы образования в основной школе Рекомендации по проведению ГИА-9 по информатике и ИКТ
Рекомендации по проведению ГИА-9 по информатике и ИКТ Опыт внедрения системы управленческого учета на примере ЗАО «Свердловский камвольный комбинат»
Опыт внедрения системы управленческого учета на примере ЗАО «Свердловский камвольный комбинат» Основы учения о конституции. (Тема 1)
Основы учения о конституции. (Тема 1) Zaschita_Kursovaya_2 (1)
Zaschita_Kursovaya_2 (1) Наркомания
Наркомания Творчество художника Е. И. чарушина
Творчество художника Е. И. чарушина ВКР: Проект плавильного и формовочного отделений цеха чугунного литья мощностью
ВКР: Проект плавильного и формовочного отделений цеха чугунного литья мощностью Law project
Law project Декоративно-пркладное искусство России
Декоративно-пркладное искусство России Психолого-педагогическое сопровождение субъектов образования в процессе подготовки к ГИА
Психолого-педагогическое сопровождение субъектов образования в процессе подготовки к ГИА Олимпийские дисциплины в плавании
Олимпийские дисциплины в плавании Неизвестные факты об известных открытиях
Неизвестные факты об известных открытиях Sposobnosti_1
Sposobnosti_1 Сообщение по биологии на тему «Утконос» Ученика 7В класса школы №5 Бережняка Никиты
Сообщение по биологии на тему «Утконос» Ученика 7В класса школы №5 Бережняка Никиты Коллекторный электродвигатель постоянного тока
Коллекторный электродвигатель постоянного тока Финкульт привет - онлайн-форум
Финкульт привет - онлайн-форум По вопросам аренды: Зам. Генерального директора Мальков Александр Валерьевич 8(499) 611-54-45, моб. 8(985)761-68-92, e-mail:
По вопросам аренды: Зам. Генерального директора Мальков Александр Валерьевич 8(499) 611-54-45, моб. 8(985)761-68-92, e-mail: