Содержание
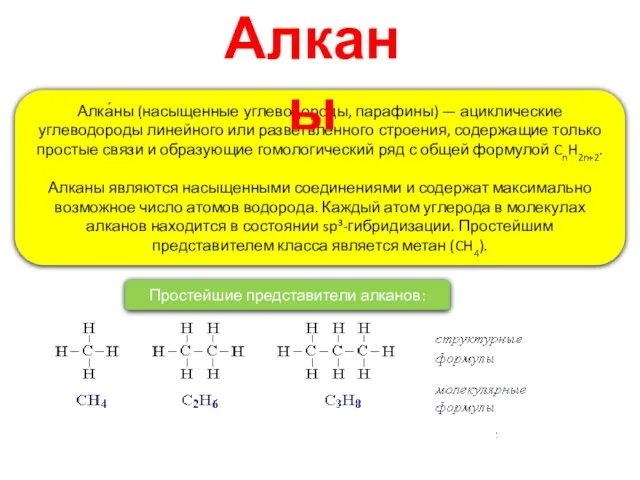
- 2. Алка́ны (насыщенные углеводороды, парафины) — ациклические углеводороды линейного или разветвлённого строения, содержащие только простые связи и
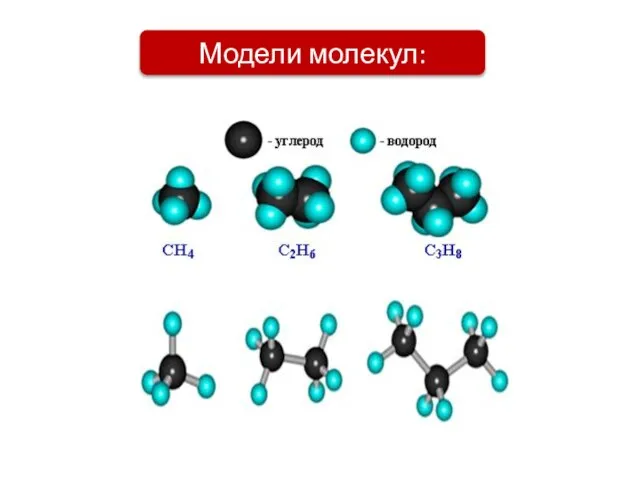
- 3. Модели молекул:
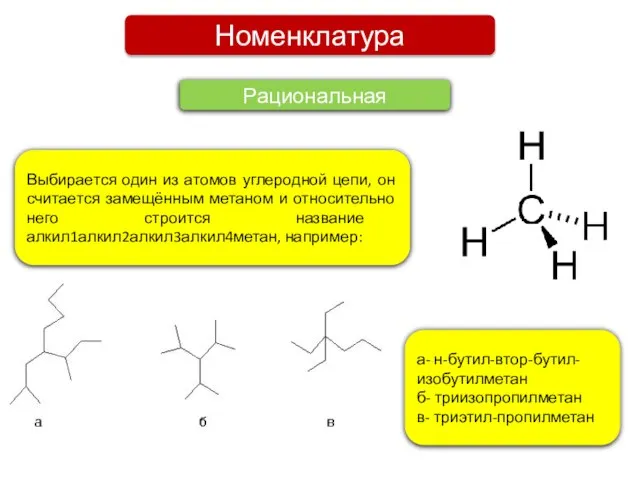
- 4. Номенклатура Рациональная Выбирается один из атомов углеродной цепи, он считается замещённым метаном и относительно него строится
- 5. Систематическая ИЮПАК По номенклатуре ИЮПАК названия алканов образуются при помощи суффикса -ан путём добавления к соответствующему
- 6. Гомологический ряд и изомерия Изомерия предельных углеводородов обусловлена простейшим видом структурной изомерии — изомерией углеродного скелета.
- 7. Физические свойства Температуры плавления и кипения увеличиваются с молекулярной массой и длиной главной углеродной цепи При
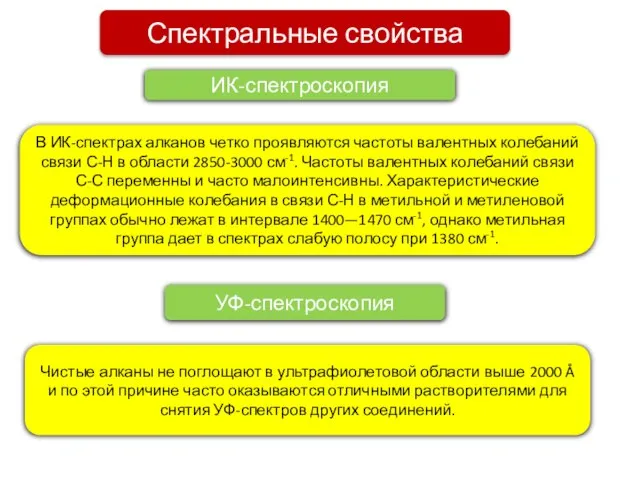
- 8. Спектральные свойства ИК-спектроскопия В ИК-спектрах алканов четко проявляются частоты валентных колебаний связи С-Н в области 2850-3000
- 9. Химические свойства Алканы имеют низкую химическую активность. Это объясняется тем, что единичные C-H и C-C связи
- 10. Галогенирование Галогенирование алканов протекает по радикальному механизму. Для инициирования реакции необходимо смесь алкана и галогена облучить
- 11. Нитрование Алканы реагируют с азотной кислотой или N2O4 в газовой фазе с образованием нитропроизводных: RH +
- 12. Крекинг При нагревании выше 500 °C алканы подвергаются пиролитическому разложению с образованием сложной смеси продуктов, состав
- 13. Получение Главным источником алканов (а также других углеводородов) является нефть и природный газ, которые обычно встречаются
- 14. Восстановление спиртов Восстановление спиртов приводит к образованию углеводородов, содержащих то же количество атомов С. Так, например,
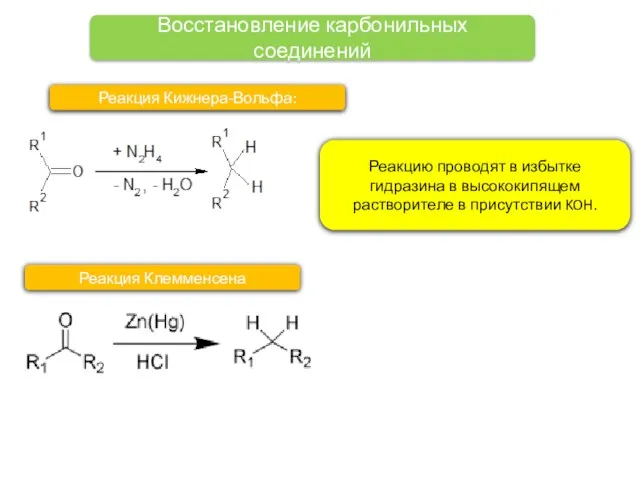
- 15. Восстановление карбонильных соединений Реакция Кижнера-Вольфа: Реакцию проводят в избытке гидразина в высококипящем растворителе в присутствии KOH.
- 16. Гидрирование непредельных углеводородов Из алкенов CnH2n+H2→CnH2n+2 Из алкинов CnH2n-2+2H2→CnH2n+2 Катализатором реакции являются соединения никеля, платины или
- 17. Синтез Кольбе При электролизе солей карбоновых кислот, анион кислоты — RCOO- перемещается к аноду, и там,
- 18. Газификация твердого топлива Проходит при повышенной температуре и давлении. Катализатор Ni: C+2H2 → CH4
- 19. Реакция Вюрца Реакция Вюрца, или синтез Вюрца — метод синтеза симметричных насыщенных углеводородов действием металлического натрия
- 21. Скачать презентацию













 photoshop
photoshop Общение родителей и детей как условие успеха воспитания
Общение родителей и детей как условие успеха воспитания Кожевенное сырье
Кожевенное сырье Волнистые попугайчики
Волнистые попугайчики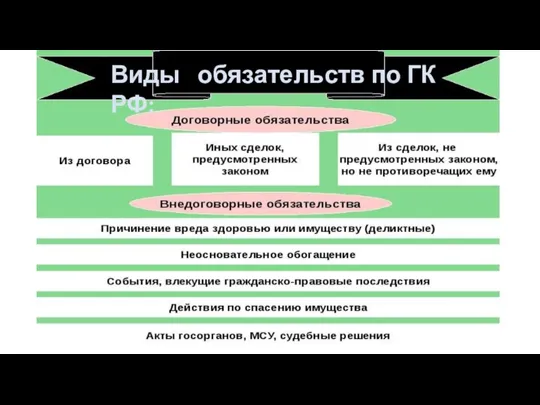 Виды обязательств в ГК РФ
Виды обязательств в ГК РФ гр право
гр право Требования к эссе. Гендерное равенство и право
Требования к эссе. Гендерное равенство и право Свет и его законы
Свет и его законы Деятельность ФСИН России
Деятельность ФСИН России Инновации в автоматизации продвижения сайтов
Инновации в автоматизации продвижения сайтов Смелый набег. Вятский край в эпоху феодализма. (9 класс)
Смелый набег. Вятский край в эпоху феодализма. (9 класс) Русское искусство первой половины XIX века
Русское искусство первой половины XIX века Valpurgiyev’s night From April 30 to May
Valpurgiyev’s night From April 30 to May Приемы развития ИСУД ученика средствами предмета
Приемы развития ИСУД ученика средствами предмета Методология научной деятельности. Тема, объект, предмет, исследования
Методология научной деятельности. Тема, объект, предмет, исследования Устройство гранаты
Устройство гранаты Виды и типы сетевых продовольственных магазинов
Виды и типы сетевых продовольственных магазинов Профессия МЕНЕДЖЕР
Профессия МЕНЕДЖЕР Международные финансовые отношения и развития валютных систем
Международные финансовые отношения и развития валютных систем Дэлхийн х?н ам
Дэлхийн х?н ам halloween_vocabulary
halloween_vocabulary Растительный и животный мир
Растительный и животный мир Схемы по Прекращению обязательств
Схемы по Прекращению обязательств Презентация на тему Пещерные храмы в Эллоре
Презентация на тему Пещерные храмы в Эллоре  Ориентирование на местности
Ориентирование на местности Методическая разработка внеаудиторного мероприятия
Методическая разработка внеаудиторного мероприятия Каталог TopFranchise. Коммерческое предложение по сотрудничеству
Каталог TopFranchise. Коммерческое предложение по сотрудничеству Шаблон для презентации
Шаблон для презентации