Содержание
- 2. «Открытие алюминия» В 1825 г. датский физик Ханс Кристиан Эрстед был первым, кому удалось, подобно неизвестному
- 3. «Серебро из глины» Немецкий учёный Ф. Велер (1827 г.) получил алюминий при нагревании хлорида алюминия со
- 4. «Электролитический способ» В 1886 году Поль Эру французский инженер-химик запатентовал открытие способа получения алюминия Чарльз Мартин
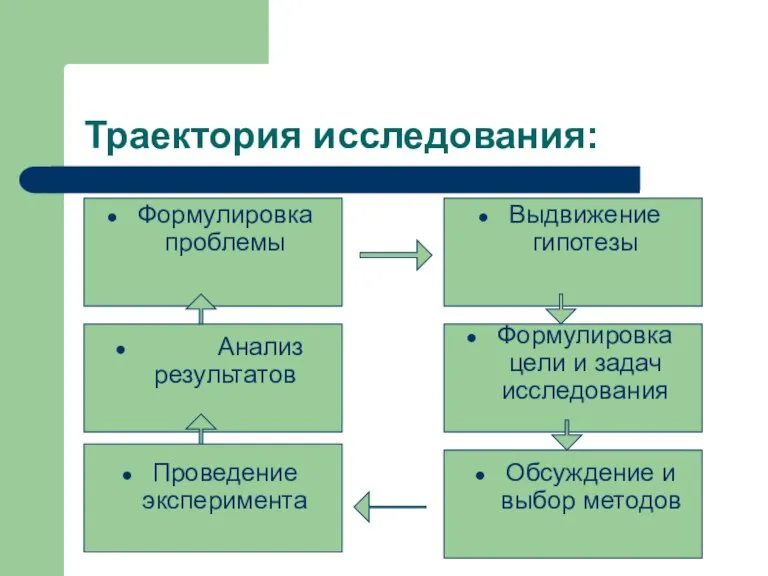
- 5. Траектория исследования: Формулировка проблемы Выдвижение гипотезы Формулировка цели и задач исследования Проведение эксперимента Обсуждение и выбор
- 6. Проблемный вопрос: «Алюминий – металл будущего?»
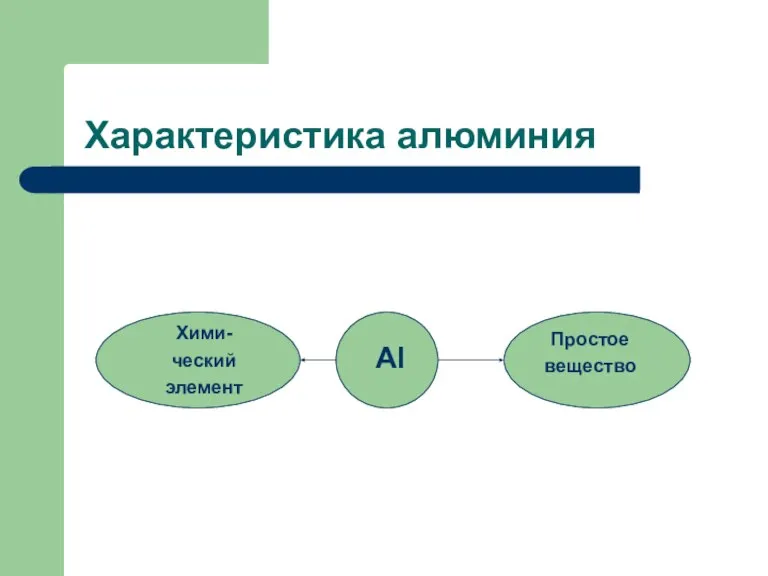
- 7. Характеристика алюминия Al Хими- ческий элемент Простое вещество
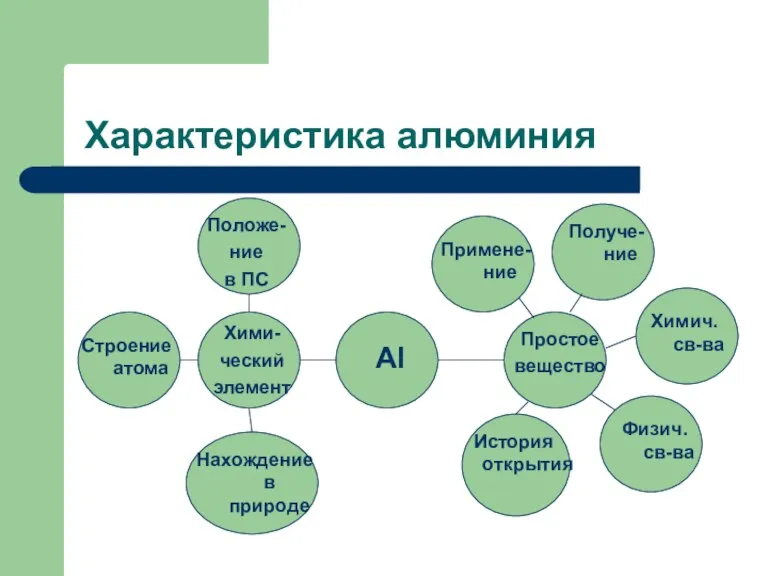
- 8. Характеристика алюминия Положе- ние в ПС Строение атома Примене- ние Al Хими- ческий элемент Нахождение в
- 9. Цель и задачи исследования: Ответить на вопрос: « Почему алюминий называют металлом будущего?» Дать характеристику элемента
- 10. Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома. Порядковый номер 13 . Алюминий - элемент III группы,
- 11. Положение алюминия в ПСХЭ Д.И.Менделеева. Строение атома. Порядковый номер 13 . Алюминий - элемент III группы,
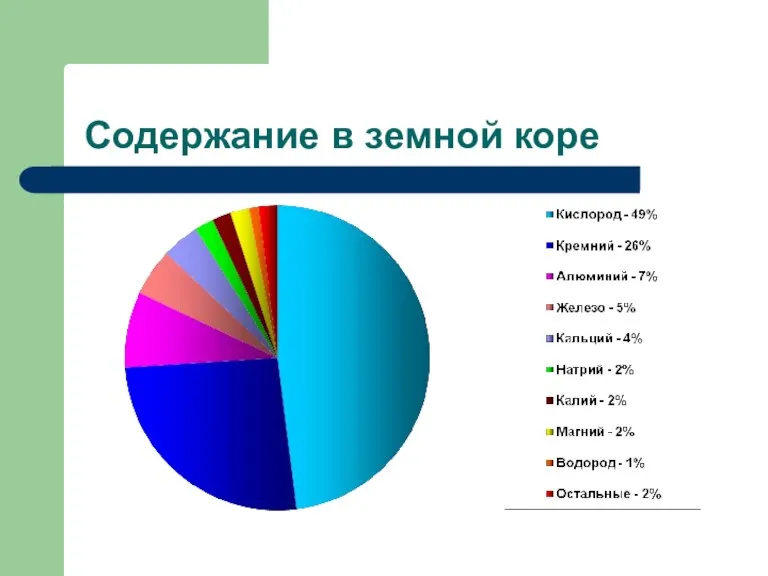
- 12. Содержание в земной коре
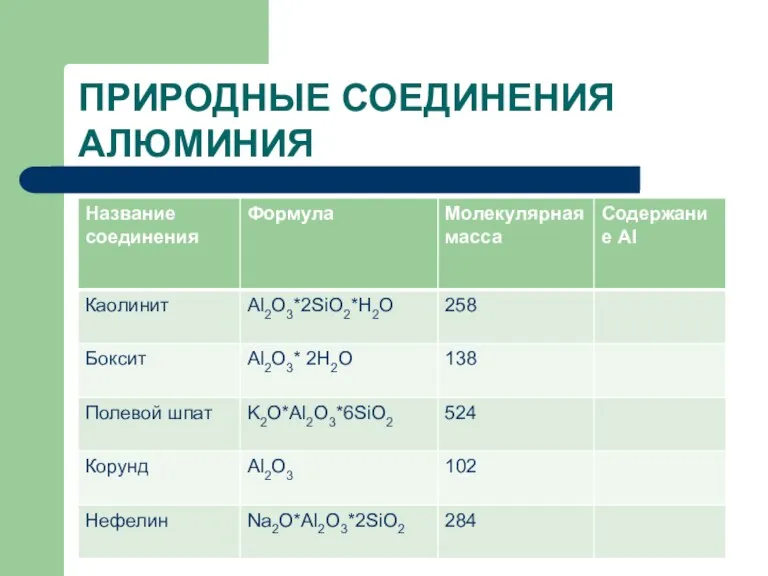
- 13. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
- 14. ПРИРОДНЫЕ СОЕДИНЕНИЯ АЛЮМИНИЯ
- 15. Физические свойства
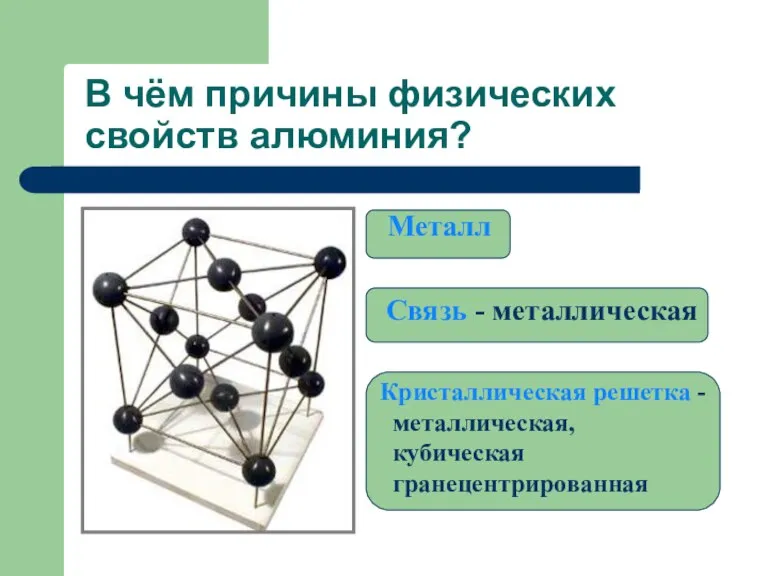
- 16. В чём причины физических свойств алюминия? Металл Связь - металлическая Кристаллическая решетка - металлическая, кубическая гранецентрированная
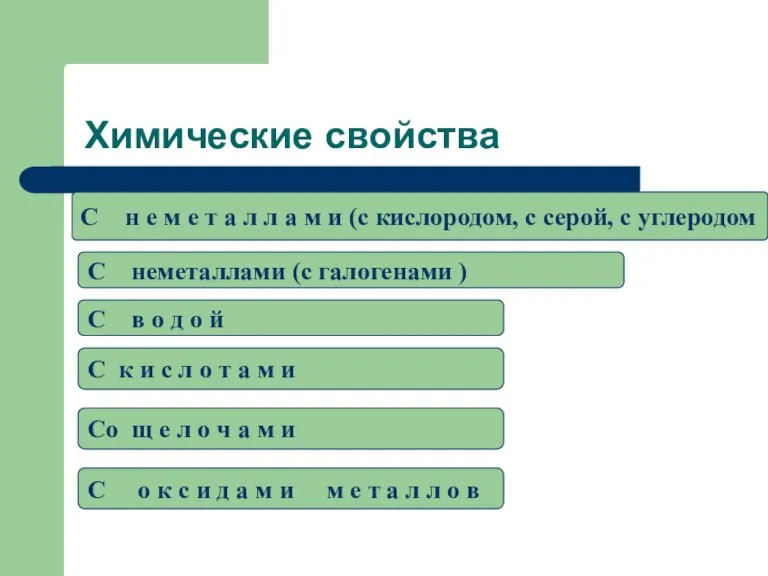
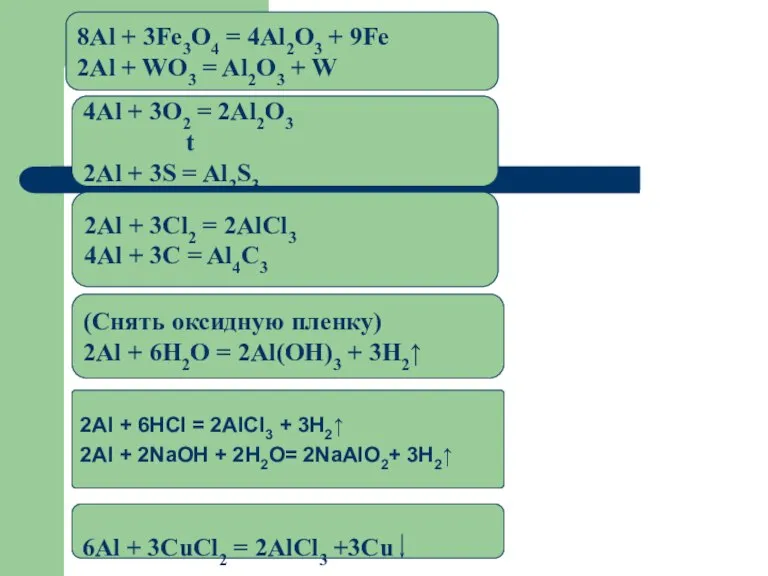
- 17. Химические свойства C н е м е т а л л а м и (c кислородом,
- 19. 2Al + 6HCl = 2AlCl3 + 3H2↑ 2Al + 2NaOH + 2H2O= 2NaAlO2+ 3H2↑ (Снять оксидную
- 20. Химические свойства Алюминий - очень активный металл. В реакциях он проявляет восстановительные свойства. Реагирует с простыми
- 21. Применение алюминия
- 23. Скачать презентацию












 Немецкий импрессионист Второй Мировой. Отто Дикс.
Немецкий импрессионист Второй Мировой. Отто Дикс. Государственный флаг – один из символов России
Государственный флаг – один из символов России Как уйти или кем остаться?
Как уйти или кем остаться? Презентация сотрудников Центрального банка Республики Узбекистан на встрече с представителями Центрального банка Турции
Презентация сотрудников Центрального банка Республики Узбекистан на встрече с представителями Центрального банка Турции Светодиодные полы – это особенное украшение любого помещения, оборудованного для отдыха и проведения мероприятий. Компания LeDFloo
Светодиодные полы – это особенное украшение любого помещения, оборудованного для отдыха и проведения мероприятий. Компания LeDFloo Презентация на тему Кожевенные товары
Презентация на тему Кожевенные товары Векторная графика
Векторная графика Такесика
Такесика Неметаллы
Неметаллы Источники низкочастотного ЭМП (0-3 кГц):
Источники низкочастотного ЭМП (0-3 кГц): Новые встречи в оперном театре
Новые встречи в оперном театре Информационное сотрудничество между застройщиками и СМИ.
Информационное сотрудничество между застройщиками и СМИ. ГИА 9 класс 2012
ГИА 9 класс 2012 Презентация на тему Как подготовиться к путешествию
Презентация на тему Как подготовиться к путешествию  Презентация на тему Охрана растений
Презентация на тему Охрана растений СРМП4_Tanetova_Lazzat_presentation (копия) (копия) (копия)
СРМП4_Tanetova_Lazzat_presentation (копия) (копия) (копия) Презентация на тему Химические антонимы
Презентация на тему Химические антонимы Источник питания - Ключ к эффективному и надёжному Светодиодному освещению
Источник питания - Ключ к эффективному и надёжному Светодиодному освещению Правовой режим недр (тема 3)
Правовой режим недр (тема 3) Изучение инструктивно-методических материалов как одно из важнейших направлений деятельности ШМО
Изучение инструктивно-методических материалов как одно из важнейших направлений деятельности ШМО Анализ и оптимизация работы фонтанных скважин
Анализ и оптимизация работы фонтанных скважин Жизненные пути Пьера Безухова и Андрей Болконского
Жизненные пути Пьера Безухова и Андрей Болконского Учение Чарльза Дарвина
Учение Чарльза Дарвина Скрапбукинг как искусство
Скрапбукинг как искусство Сервис транспортных и технологических машин и оборудования
Сервис транспортных и технологических машин и оборудования Государственный аудит
Государственный аудит  Пешка против ферзя, ладьи, коня, слона
Пешка против ферзя, ладьи, коня, слона Вопросы наследования. Социологическое исследование
Вопросы наследования. Социологическое исследование