Содержание
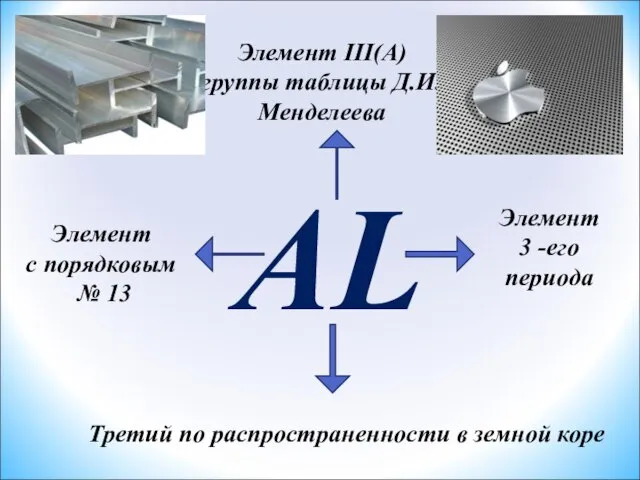
- 2. AL Элемент III(A) группы таблицы Д.И.Менделеева Элемент с порядковым № 13 Элемент 3 -его периода Третий
- 3. Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгамы калия на хлорид
- 4. Получение Современный метод получения был разработан независимо друг от друга американцем Чарльзом Холлом и французом Полем
- 5. Чарльз Холл Холл Чарльз (1863 – 1914)- американский инженер-химик. Будучи студентом Оберлинского колледжа, на лекциях узнал,
- 6. Поль Эру В начале 1886 года он изобрел такой же метод промышленного получения алюминия электролизом криолитно-глиноземного
- 7. Нахождение в природе Важнейшим на сегодня минералом алюминия является боксит , основа которого оксид алюминия(AL2O3) .
- 8. Легко реагирует с простыми веществами: с кислородом, образуя оксид алюминия: 4Al + 3O2 = 2Al2O3 с
- 9. Химические свойства Со сложными веществами: с водой (после удаления защитной оксидной пленки) 2Al + 6H2O =
- 10. ПРИМЕНЕНИЕ АЛЮМИНИЯ
- 12. Скачать презентацию








 Презентация на тему Строение цветка
Презентация на тему Строение цветка  Астероиды - малые планеты
Астероиды - малые планеты «Свободная цена»: решение для независимых музыкантов и НКО
«Свободная цена»: решение для независимых музыкантов и НКО Теория фотоэффекта
Теория фотоэффекта Артикуляционная гимнастика
Артикуляционная гимнастика Сущность и структура морали
Сущность и структура морали Здоровье и болезнь.
Здоровье и болезнь. Организация питания в МДОУ № 4
Организация питания в МДОУ № 4 Духовно-нравственное воспитание в ДОУ
Духовно-нравственное воспитание в ДОУ Российская академия народного хозяйства и государственной службыпри Президенте Российской ФедерацииНИЖЕГОРОДСКИЙ ИНСТИТУТ УП
Российская академия народного хозяйства и государственной службыпри Президенте Российской ФедерацииНИЖЕГОРОДСКИЙ ИНСТИТУТ УП DOC-20220912-WA0009
DOC-20220912-WA0009 Презентация на тему Лезгины
Презентация на тему Лезгины  Образ Базарова в романе И С Тургенева «Отцы и дети
Образ Базарова в романе И С Тургенева «Отцы и дети © 2009 Promodo www.promodo.ru e-mail:
© 2009 Promodo www.promodo.ru e-mail:  Положительные и отрицательные числа
Положительные и отрицательные числа слоны
слоны Основы методики самостоятельных занятий физическими упражнениями
Основы методики самостоятельных занятий физическими упражнениями Повторение понятий
Повторение понятий Новгородская земля
Новгородская земля  Компания Агротрак. Продажа, ремонт и изготовление радиаторов на заказ. Запчасти на всю линейку Кировец напрямую
Компания Агротрак. Продажа, ремонт и изготовление радиаторов на заказ. Запчасти на всю линейку Кировец напрямую ФГОС. Концепции, результаты, перспективы
ФГОС. Концепции, результаты, перспективы Разбор
Разбор Презентация
Презентация Всероссийский форсайт библиотек Тула
Всероссийский форсайт библиотек Тула Лансере Евгений Александрович
Лансере Евгений Александрович Заболевания ногтей
Заболевания ногтей Роберт Шекли
Роберт Шекли Движение - это жизнь
Движение - это жизнь