Содержание
- 2. Дать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах; Повторить, закрепить и развить знания о
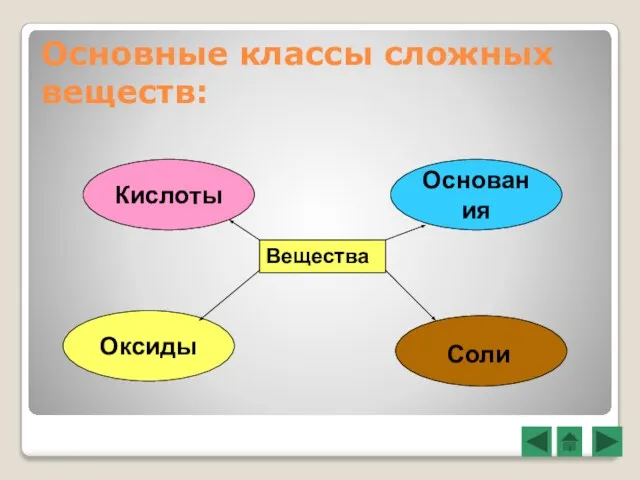
- 3. Основные классы сложных веществ: Вещества Кислоты Основания Оксиды Соли
- 4. Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со
- 5. Задание 1 Выберите из списка веществ оксиды: H2O, CO2, P2O5, WO3 Fe2O3 SO3, CaCl2, SCl6, CuO,
- 7. Распределите вещества по классам
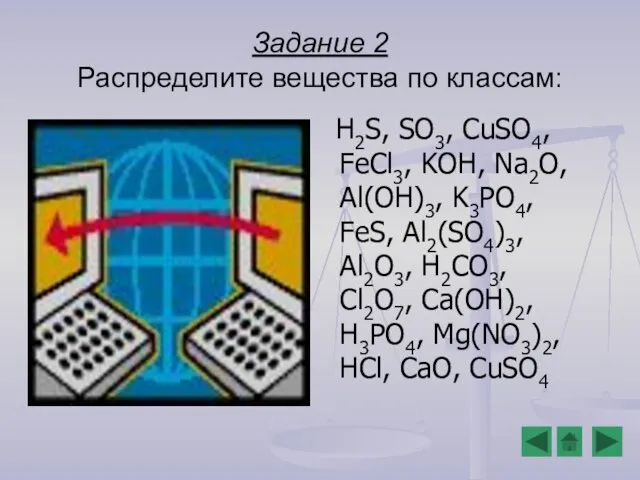
- 8. Задание 2 Распределите вещества по классам: H2S, SO3, CuSO4, FeCl3, KOH, Na2O, Al(OH)3, K3PO4, FeS, Al2(SO4)3,
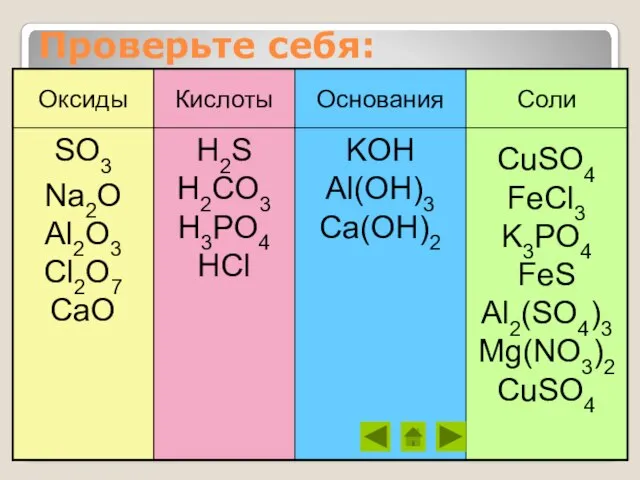
- 9. Проверьте себя:
- 10. Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки
- 11. Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со
- 12. Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя
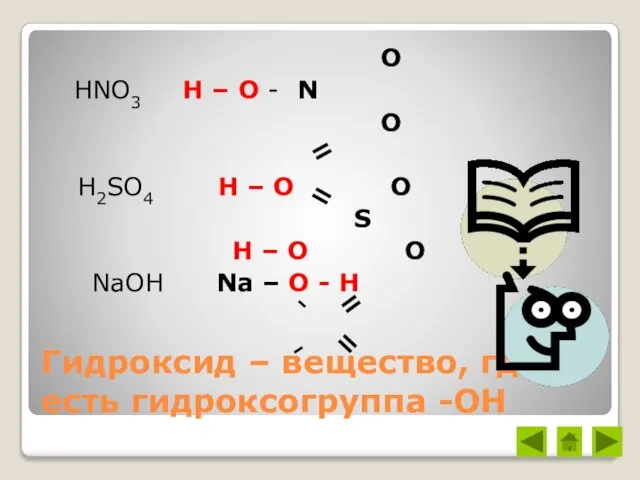
- 13. Гидроксид – вещество, где есть гидроксогруппа -ОН O HNO3 H – O - N O H2SO4
- 14. Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота
- 15. Al(OH)3 + 3HCl = AlCl3 +3H2O H3AlO3 + 3NaOH = Na3AlO3+3H2O Хлорид алюминия Алюминат натрия Запишите
- 16. Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 3NaOH = Na3AlO3 + 3H2O Как основный
- 17. Амфотерные Оксиды металлов (с.о. +2,+3,+4)
- 18. Какие из групп веществ проявляют амфотерные свойства? Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2 Fe2O3, Al2O3, Fe(OН)3 , ZnO,
- 19. Допишите уравнение реакции: Zn(OH)2 + 2NaOH в результате образуются Na2ZnO2 + 2H2O Zn(OH)2 + Na2O ZnSO4
- 21. Скачать презентацию













 Главные члены предложения
Главные члены предложения Презентация на тему Автостат
Презентация на тему Автостат  Целевые показатели при реализации мероприятий по формированию современных механизмов в дополнительном образовании детей
Целевые показатели при реализации мероприятий по формированию современных механизмов в дополнительном образовании детей Мастер-класс
Мастер-класс Экоклуб Друзей WWF и Природного парка Зона покоя Укок ИРБИЗЕК
Экоклуб Друзей WWF и Природного парка Зона покоя Укок ИРБИЗЕК ДЕТИ ВОЕННОЙ ПОРЫ
ДЕТИ ВОЕННОЙ ПОРЫ Класс Птицы
Класс Птицы ВКР: Реставрация секретера
ВКР: Реставрация секретера Древние Соборы
Древние Соборы Основания отказа в возбуждении уголовного дела. Подготовила: Студентка юридического факультета Учебной группы Ю-113б Кочеткова Е
Основания отказа в возбуждении уголовного дела. Подготовила: Студентка юридического факультета Учебной группы Ю-113б Кочеткова Е Натуральный каучук
Натуральный каучук Элементы ландшафтного дизайна
Элементы ландшафтного дизайна Введение
Введение Botanical Effects
Botanical Effects Радуга
Радуга Learn to read maps
Learn to read maps Диаграмма связей MindMap. Инфографика. Лекция 3
Диаграмма связей MindMap. Инфографика. Лекция 3 Prezentatsia_dlya_vvodnogo_uroka_v_10_klasse_Russkiy_yazyk_v_sovremennom_mire
Prezentatsia_dlya_vvodnogo_uroka_v_10_klasse_Russkiy_yazyk_v_sovremennom_mire Федеральный государственный образовательный стандарт начального общего образования по литературному чтению
Федеральный государственный образовательный стандарт начального общего образования по литературному чтению Еволюція BMW
Еволюція BMW Политические партии
Политические партии агро-туры
агро-туры Русский язык3 класс
Русский язык3 класс Деление с остатком Головкова Анастасия
Деление с остатком Головкова Анастасия Михайловская Елена Викторовна
Михайловская Елена Викторовна Москва – центр борьбы с ордынским владычеством
Москва – центр борьбы с ордынским владычеством Разновидности колон
Разновидности колон Восточный базар
Восточный базар