Содержание
- 2. Дать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах; Повторить, закрепить и развить знания о
- 3. Основные классы сложных веществ (повторение) Генетическая связь (повторение) Лабораторная работа Понятие амфотерности. Амфотерные оксиды и гидроксиды
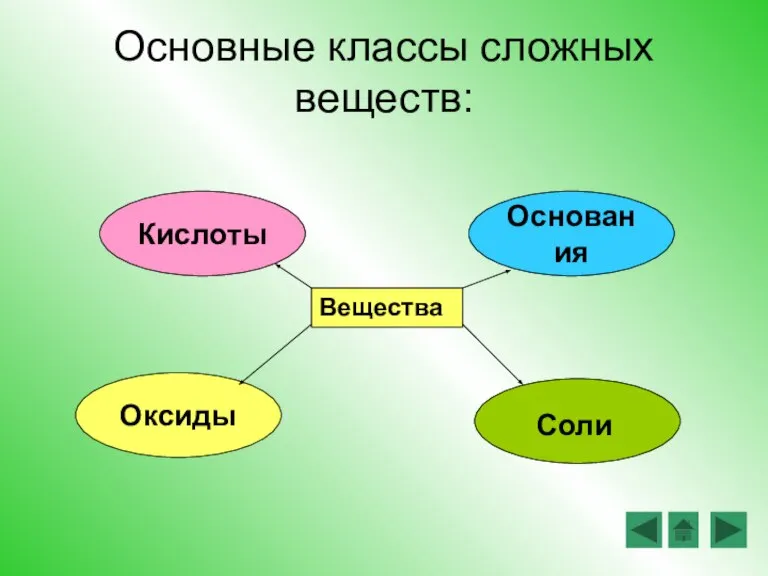
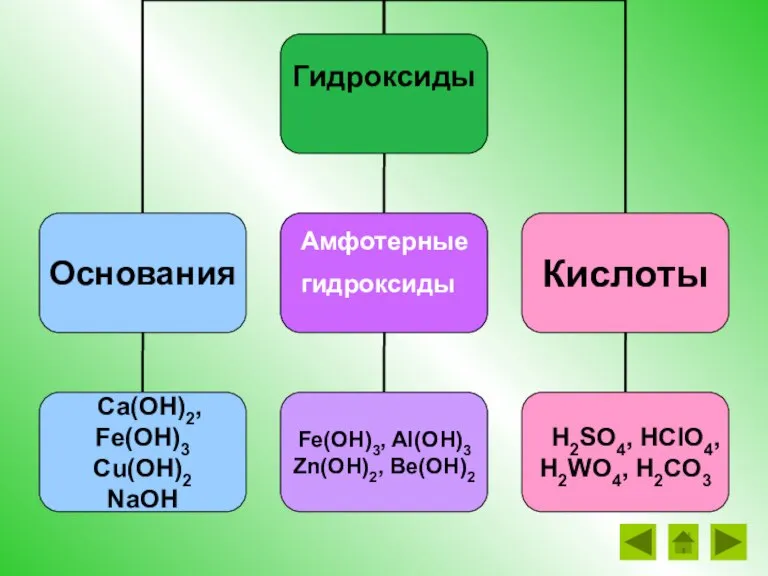
- 4. Основные классы сложных веществ: Вещества Кислоты Основания Оксиды Соли
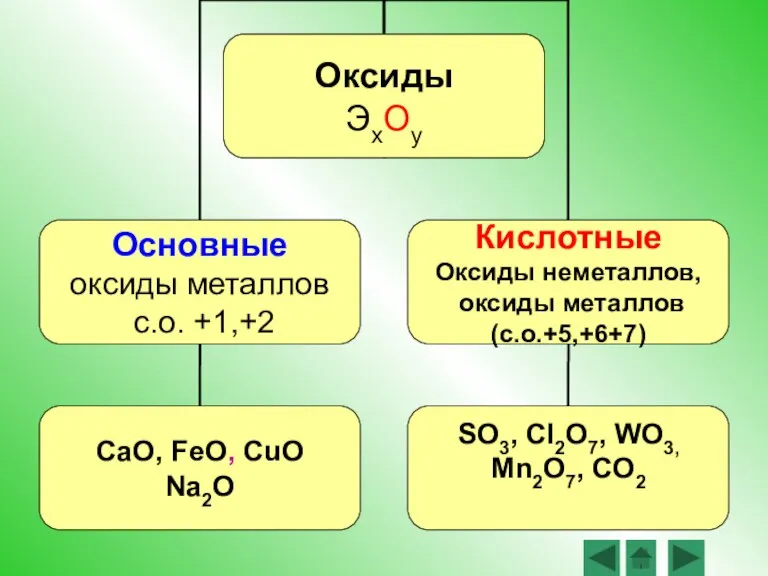
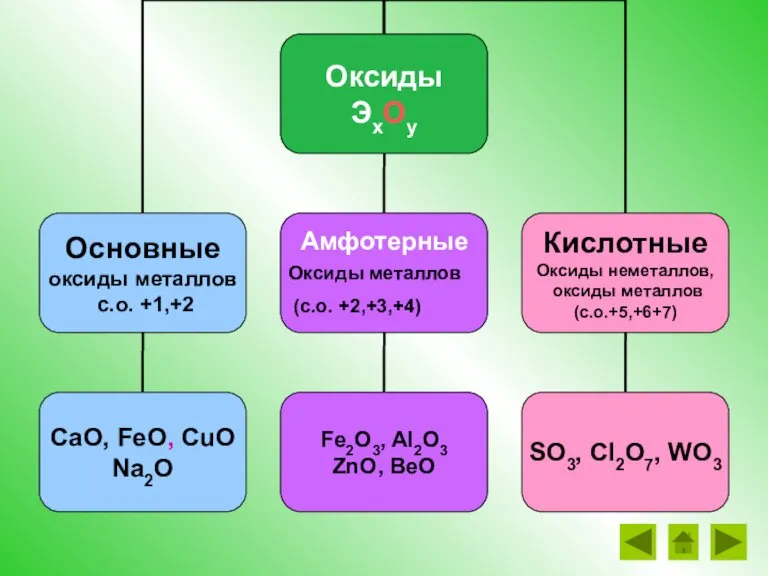
- 5. Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со
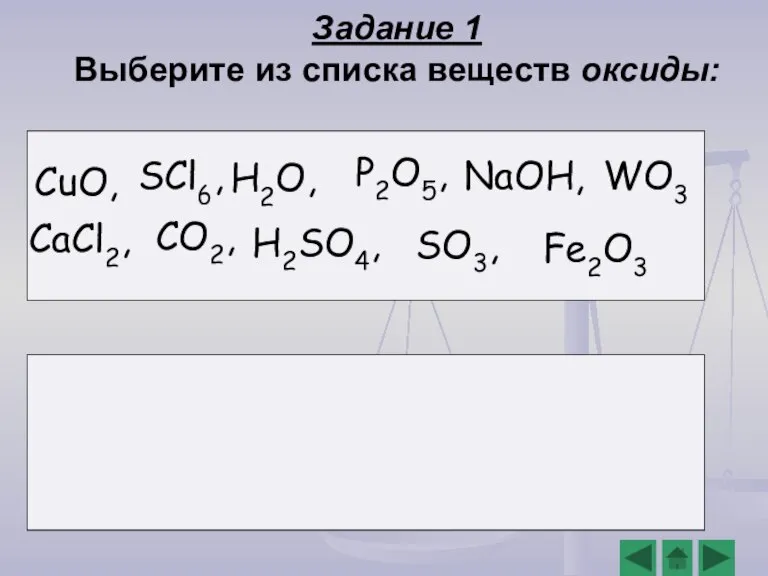
- 6. Задание 1 Выберите из списка веществ оксиды: H2O, CO2, P2O5, WO3 Fe2O3 SO3, CaCl2, SCl6, CuO,
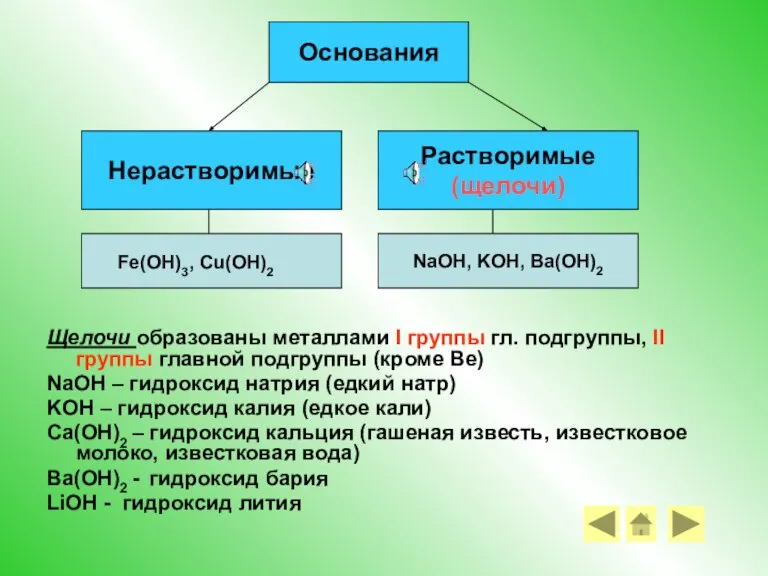
- 8. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких
- 9. Щелочи образованы металлами I группы гл. подгруппы, II группы главной подгруппы (кроме Be) NaOH – гидроксид
- 10. Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Кислородосодержащие кислоты:
- 11. Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков Соли KNO3 NaCl CuSO4
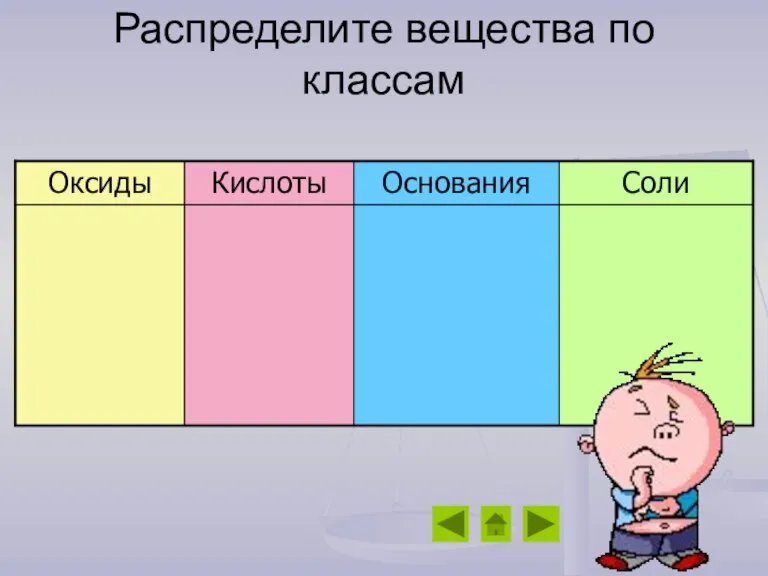
- 12. Распределите вещества по классам
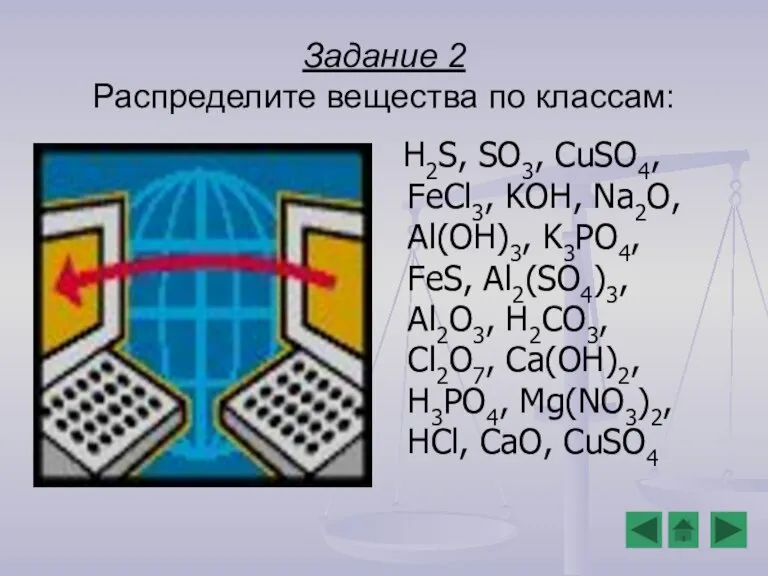
- 13. Задание 2 Распределите вещества по классам: H2S, SO3, CuSO4, FeCl3, KOH, Na2O, Al(OH)3, K3PO4, FeS, Al2(SO4)3,
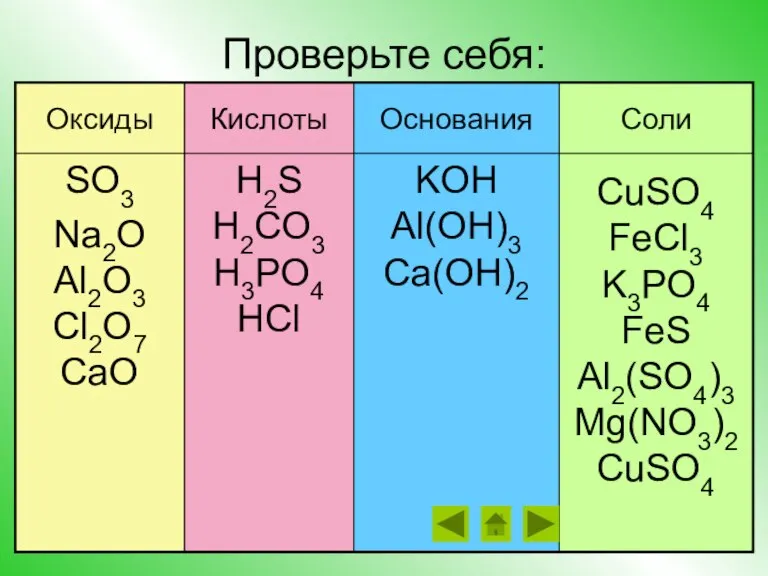
- 14. Проверьте себя:
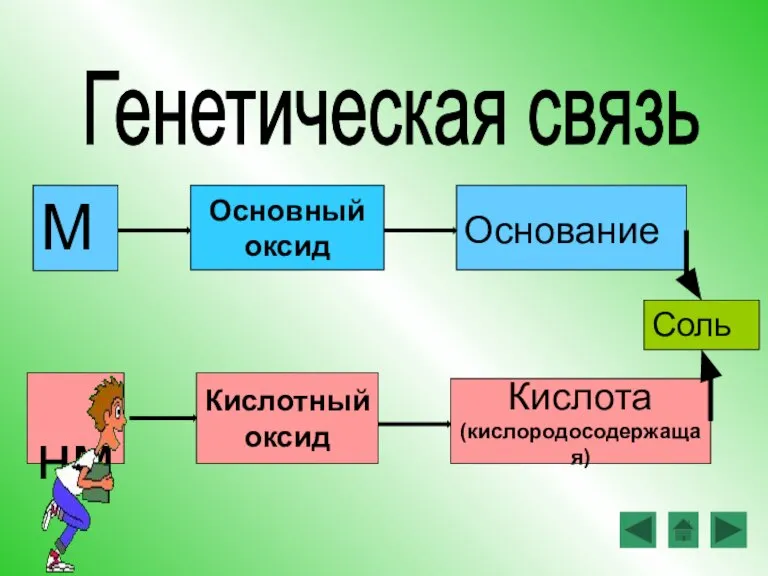
- 15. М Основание нм Кислота (кислородосодержащая) Генетическая связь Основный оксид Кислотный оксид Соль
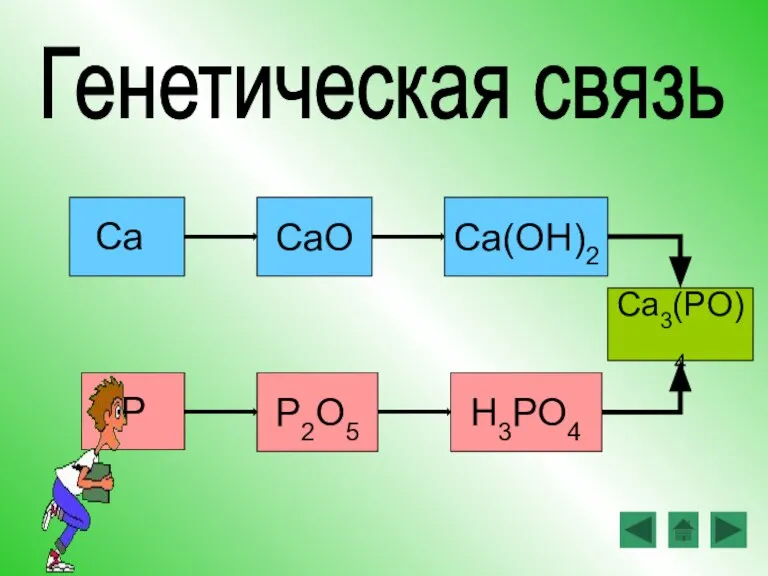
- 16. CaO Ca(OH)2 P2O5 H3PO4 P Ca Генетическая связь Ca3(PO)4
- 17. Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки
- 18. Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со
- 19. Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя
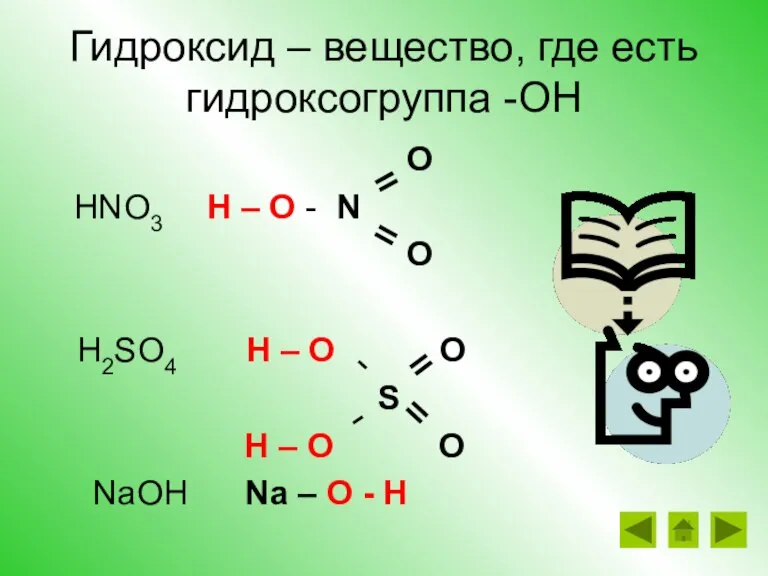
- 20. Гидроксид – вещество, где есть гидроксогруппа -ОН O HNO3 H – O - N O H2SO4
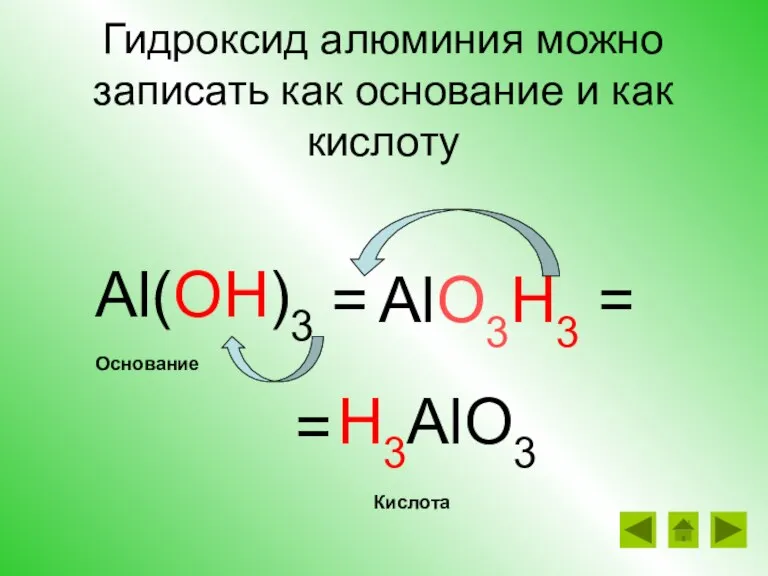
- 21. Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота
- 22. Al(OH)3 + 3HCl = AlCl3 +3H2O H3AlO3 + 3NaOH = Na3AlO3+3H2O Хлорид алюминия Алюминат натрия Запишите
- 23. Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 3NaOH = Na3AlO3 + 3H2O Как основный
- 24. Амфотерные Оксиды металлов (с.о. +2,+3,+4)
- 25. Амфотерные гидроксиды
- 26. Какие из групп веществ проявляют амфотерные свойства? Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2 Fe2O3, Al2O3, Fe(OН)3 , ZnO,
- 27. Допишите уравнение реакции: Zn(OH)2 + 2NaOH в результате образуются Na2ZnO2 + 2H2O Zn(OH)2 + Na2O ZnSO4
- 28. Совершенно верно!!!
- 29. Подумай ещё немного!
- 31. Скачать презентацию















 Заведения
Заведения Генерация идей и оценка их привлекательности
Генерация идей и оценка их привлекательности Презентация на тему Cказуемые
Презентация на тему Cказуемые  Плеврит, сухой плеврит
Плеврит, сухой плеврит «Литература»
«Литература» Границы России
Границы России Презентация на тему Расчет сопротивления проводников
Презентация на тему Расчет сопротивления проводников  Программа кандидата в члены президиума студенческого совета ЭФ СПбГУ 2012 г. созыва Половозовой Натальи Андреевны
Программа кандидата в члены президиума студенческого совета ЭФ СПбГУ 2012 г. созыва Половозовой Натальи Андреевны Основы нравственного воспитания в процессе обучения по ФГОС второго поколения
Основы нравственного воспитания в процессе обучения по ФГОС второго поколения Организация проектно-исследовательской деятельности
Организация проектно-исследовательской деятельности ПСИХОЛОГИЧЕСКАЯ ПОДГОТОВКА ВЫПУСКНИКОВ К ЭКЗАМЕНАМ.
ПСИХОЛОГИЧЕСКАЯ ПОДГОТОВКА ВЫПУСКНИКОВ К ЭКЗАМЕНАМ. Стратегии приобретений компаний-поставщиков комплектующих для автомобильной промышленности
Стратегии приобретений компаний-поставщиков комплектующих для автомобильной промышленности Тест. Искусство в моём городе (селе)
Тест. Искусство в моём городе (селе) Избирательные системы
Избирательные системы Весёлый русский язык
Весёлый русский язык Шапки
Шапки Антиправительственное движение в 1901-1904 гг
Антиправительственное движение в 1901-1904 гг Альфальфа НСП Alfalfa NSP
Альфальфа НСП Alfalfa NSP Электроника. Лекция 15
Электроника. Лекция 15 Петр Великий. Российская империя.
Петр Великий. Российская империя. Маркетинговое исследование рынка шоколада факультет экономики и управления
Маркетинговое исследование рынка шоколада факультет экономики и управления Ziemas prieki
Ziemas prieki Формирование фонда капитального ремонта в МКД
Формирование фонда капитального ремонта в МКД Прогрессивное, регрессивное и пропорциональное налогообложение: сравнительная характеристика и опыт государств
Прогрессивное, регрессивное и пропорциональное налогообложение: сравнительная характеристика и опыт государств Цель:
Цель: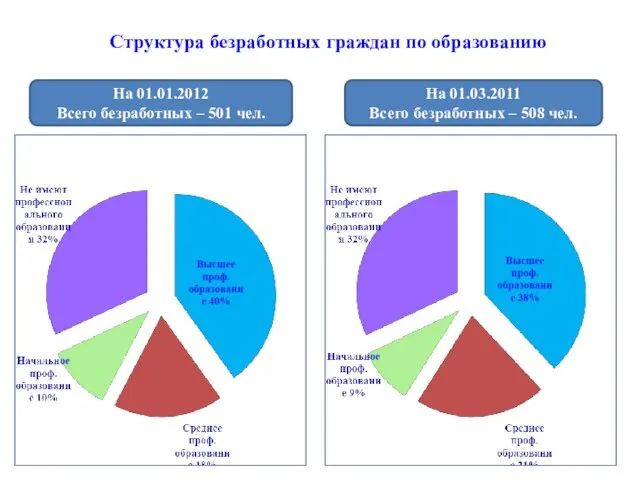 Структура безработных граждан по образованию
Структура безработных граждан по образованию Мы готовим для вас настоящие домашние торты
Мы готовим для вас настоящие домашние торты Фаина Раневская: "Чеховская героиня в советских декорациях..."
Фаина Раневская: "Чеховская героиня в советских декорациях..."