Содержание
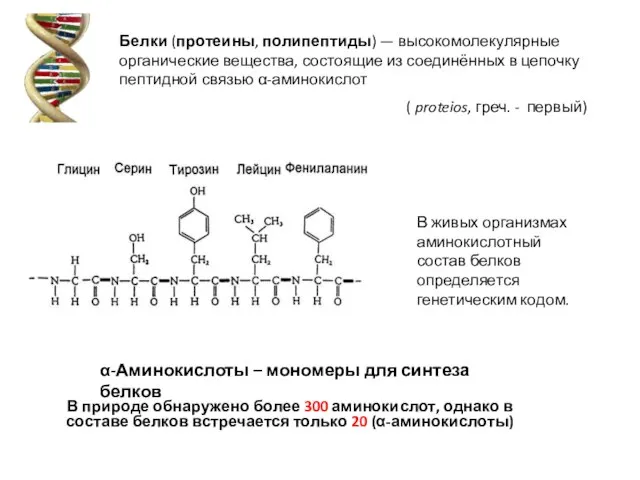
- 2. ( proteios, греч. - первый) Белки (протеины, полипептиды) — высокомолекулярные органические вещества, состоящие из соединённых в
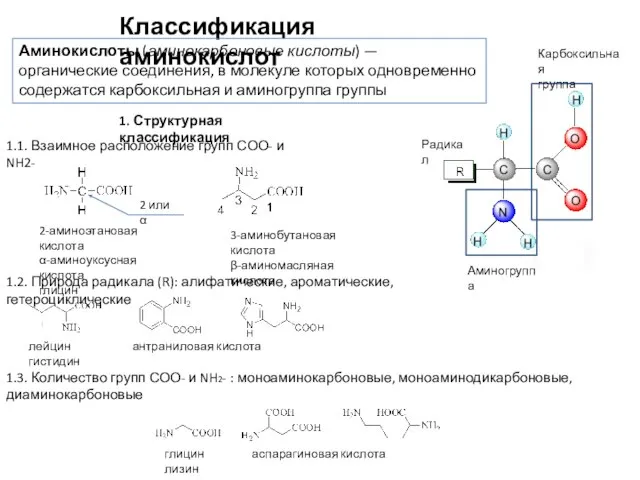
- 3. Классификация аминокислот Карбоксильная группа Радикал Аминогруппа Аминокислоты (аминокарбоновые кислоты) — органические соединения, в молекуле которых одновременно
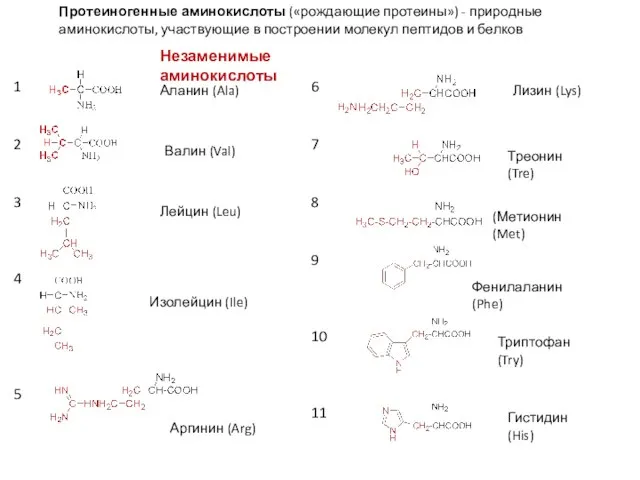
- 4. Протеиногенные аминокислоты («рождающие протеины») - природные аминокислоты, участвующие в построении молекул пептидов и белков Аланин (Ala)
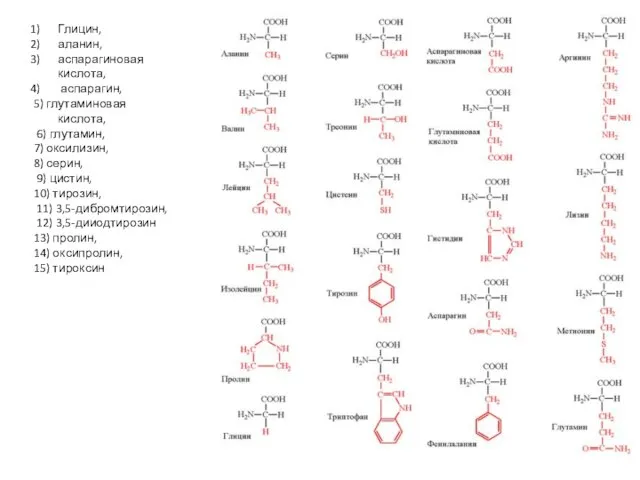
- 5. Глицин, аланин, аспарагиновая кислота, аспарагин, 5) глутаминовая кислота, 6) глутамин, 7) оксилизин, 8) серин, 9) цистин,
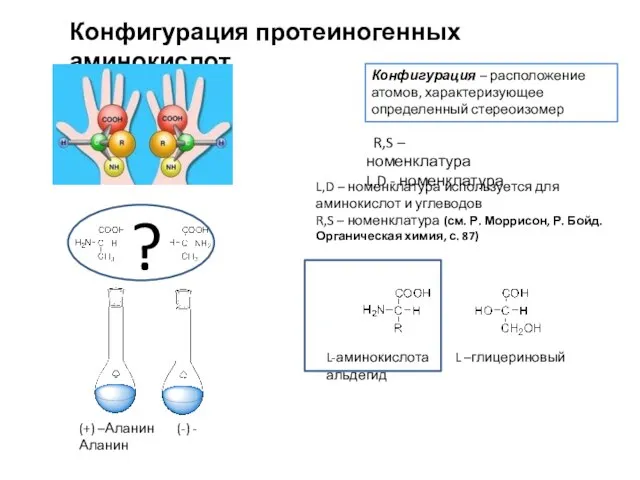
- 6. Конфигурация протеиногенных аминокислот Конфигурация – расположение атомов, характеризующее определенный стереоизомер (+) –Аланин (-) -Аланин ? L-аминокислота
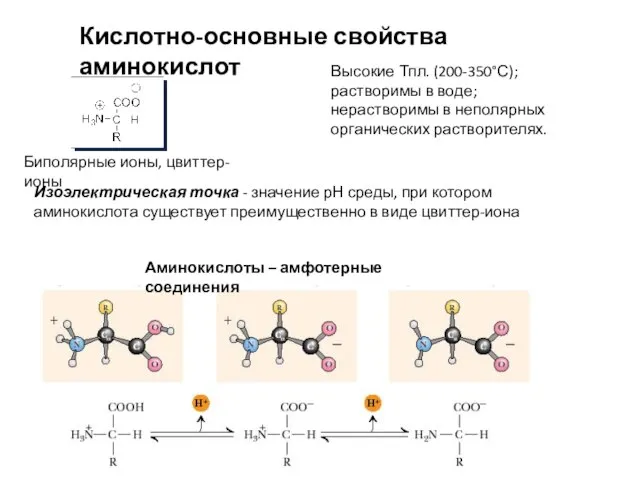
- 7. Кислотно-основные свойства аминокислот Биполярные ионы, цвиттер-ионы Высокие Тпл. (200-350°С); растворимы в воде; нерастворимы в неполярных органических
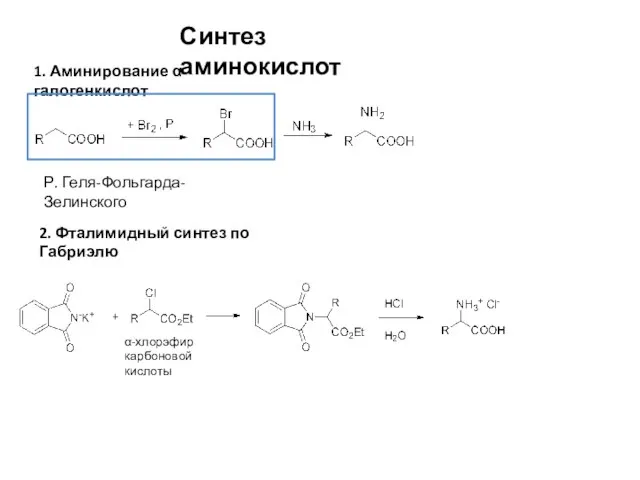
- 8. Синтез аминокислот 1. Аминирование α-галогенкислот Р. Геля-Фольгарда-Зелинского 2. Фталимидный синтез по Габриэлю α-хлорэфир карбоновой кислоты
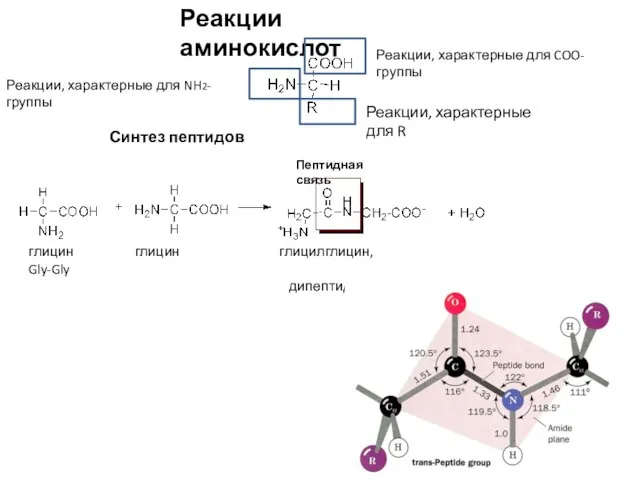
- 9. Реакции аминокислот Реакции, характерные для COO-группы Реакции, характерные для NH2-группы Реакции, характерные для R Синтез пептидов
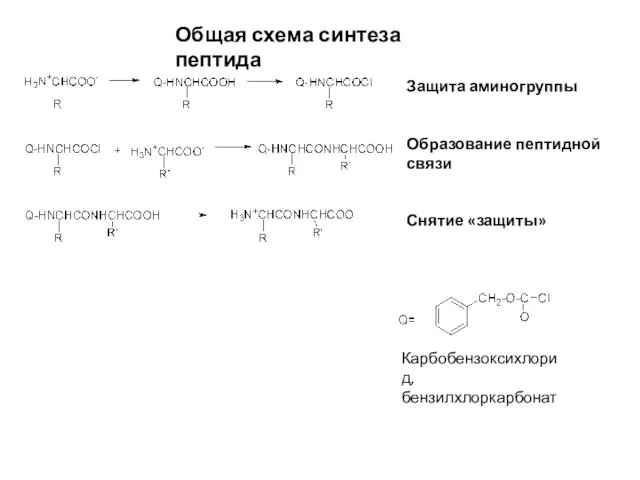
- 10. Общая схема синтеза пептида Защита аминогруппы Образование пептидной связи Снятие «защиты» Карбобензоксихлорид, бензилхлоркарбонат
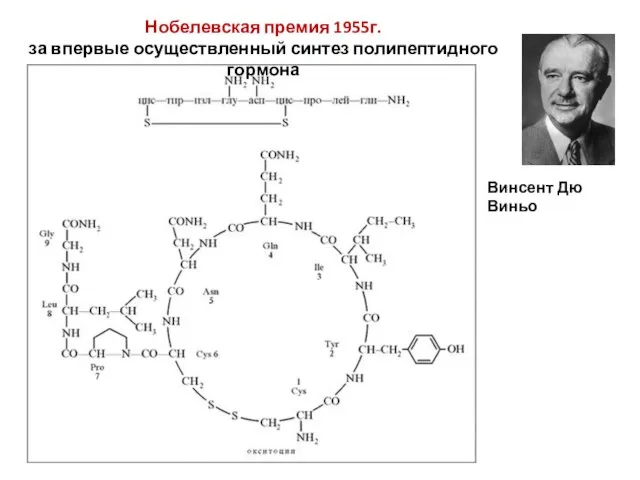
- 11. Нобелевская премия 1955г. за впервые осуществленный синтез полипептидного гормона Винсент Дю Виньо
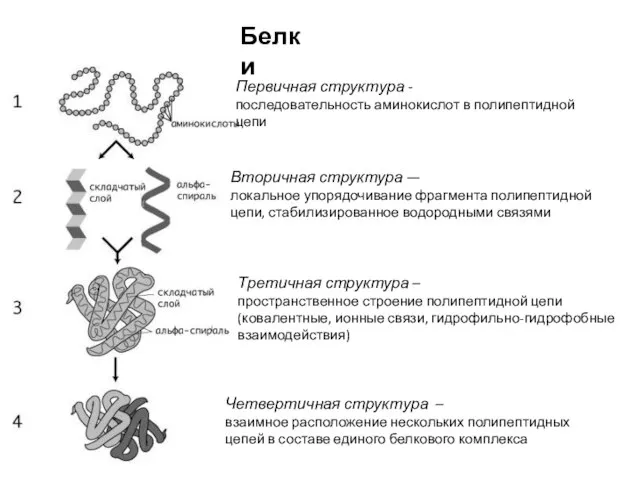
- 12. Белки Первичная структура - последовательность аминокислот в полипептидной цепи Вторичная структура — локальное упорядочивание фрагмента полипептидной
- 14. Скачать презентацию
 Attention
Attention Портфолио музыкального руководителя
Портфолио музыкального руководителя Координатная плоскость
Координатная плоскость Радиационные аварии и инциденты
Радиационные аварии и инциденты Эволюция автомобильного дизайна
Эволюция автомобильного дизайна  Приоритетные направления в развитии Юго-Западного учебного округа в 2011/2012 учебном году в свете подготовки к выполнению Государст
Приоритетные направления в развитии Юго-Западного учебного округа в 2011/2012 учебном году в свете подготовки к выполнению Государст My favorite movie
My favorite movie або Хто такі птахи-імітатори?
або Хто такі птахи-імітатори? О проекте федерального закона «О внесении изменений и дополнений в Федеральный закон «Об оценочной деятельности в Российской Фе
О проекте федерального закона «О внесении изменений и дополнений в Федеральный закон «Об оценочной деятельности в Российской Фе Презентация на тему Сверх проводимость
Презентация на тему Сверх проводимость  Самодиагностика физического развития и физической подготовленности студентов
Самодиагностика физического развития и физической подготовленности студентов Красноярский край
Красноярский край ГИА 9
ГИА 9 Когда получил аттестат и не знаешь, куда теперь идти… МГПУ ИИЯ Кафедра англистики и межкультурной коммуникации
Когда получил аттестат и не знаешь, куда теперь идти… МГПУ ИИЯ Кафедра англистики и межкультурной коммуникации Распределение финансов
Распределение финансов Графическое решение физических задач
Графическое решение физических задач Закон РФ О защите прав потребителей
Закон РФ О защите прав потребителей Презентация на тему Внутренняя среда организма
Презентация на тему Внутренняя среда организма  Технологический процесс приёма, обработки и вручения отправлений5
Технологический процесс приёма, обработки и вручения отправлений5 Презентация на тему Сумма углов треугольника. Внешний угол треугольника
Презентация на тему Сумма углов треугольника. Внешний угол треугольника Формирование физической картины мира у учащихся в процессе изучения физики в профильных классах.
Формирование физической картины мира у учащихся в процессе изучения физики в профильных классах. Пилотный проект: «Доходный дом»
Пилотный проект: «Доходный дом» ГИМНЫ
ГИМНЫ Своеобразие художественной культуры древнего востока. Символический характер искусства. Природа и человек-главная тема восточно
Своеобразие художественной культуры древнего востока. Символический характер искусства. Природа и человек-главная тема восточно Генетические основы селекции организмов
Генетические основы селекции организмов Свидетель
Свидетель Государственная политика в сфере подготовки кадров для обеспечения Единой энергетической системы Центральной Азии Иманбердиев
Государственная политика в сфере подготовки кадров для обеспечения Единой энергетической системы Центральной Азии Иманбердиев  Ветви власти по дисциплине основы права
Ветви власти по дисциплине основы права