Содержание
- 2. 1)Углеводороды с общей формулой СnН2n+2 2) Частица с одним свободным электроном 3) Суффикс "ЕН", используется в
- 3. АРЕНЫ. Представитель - С6Н6 бензол Общая формула - СnН2n-6
- 4. История открытия 1.Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году
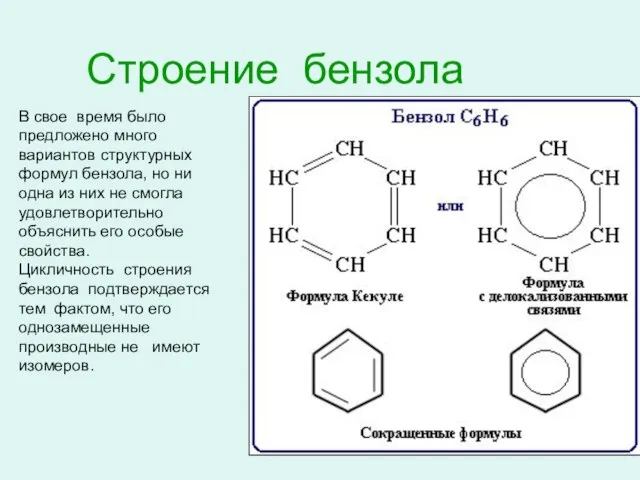
- 5. Строение бензола В свое время было предложено много вариантов структурных формул бензола, но ни одна из
- 6. Получение Бензол получают из каменноугольной смолы, образующейся при коксовании угля. В настоящее время бензол получают из
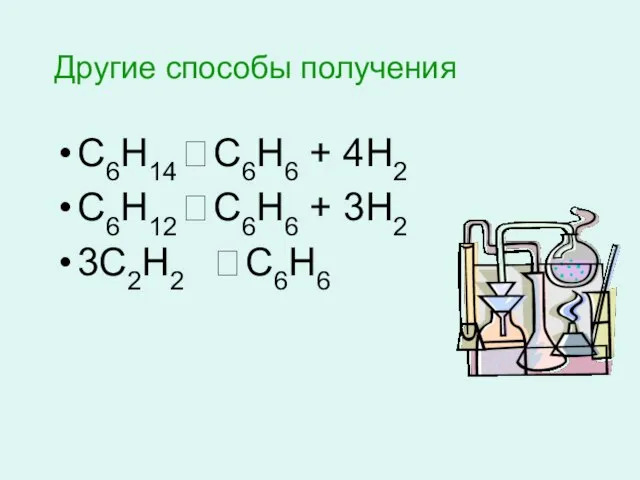
- 7. Другие способы получения С6Н14 ? С6Н6 + 4Н2 С6Н12 ? С6Н6 + 3Н2 3С2Н2 ? С6Н6
- 8. Природные источники получения: Природные и попутные газы Нефть Каменный уголь
- 9. Физические свойства Бензол представляет собой бесцветную, легкоподвижную жидкость с температурой кипения +80ºС и температурой плавления +
- 10. Химические свойства 1.Горение бензола: 2С6Н6 + 15О2 = 12СО2 + 6Н2О 2. Реакция замещения: С6Н6 +
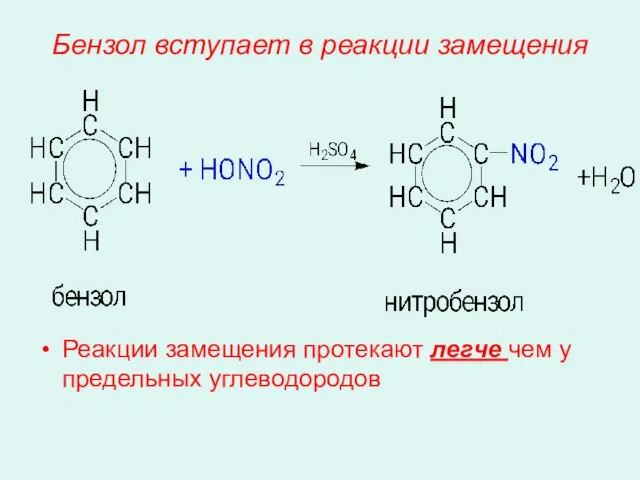
- 11. Бензол вступает в реакции замещения Реакции замещения протекают легче чем у предельных углеводородов
- 13. Скачать презентацию







 Инфраструктурные инвестиции
Инфраструктурные инвестиции Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09
Културен туризъм: международен маркетинг Бележки към кръглата маса организирана от ПП ГЕРБ Асеновград, 23.06.09 Pos материалы гербион
Pos материалы гербион Презентация на тему Неофициальные символы России
Презентация на тему Неофициальные символы России CPA launches FOD
CPA launches FOD Методы и приборы разрушающего контроля, применяемые при обследовании
Методы и приборы разрушающего контроля, применяемые при обследовании ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ
ЖИЗНЬ И БЫТ В СРЕДНЕВЕКОВОМ ЗАМКЕ Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи»
Презентация компании MOST Marketing«Франчайзинговый пакет: как разработать,чтобы привлечь франчайзи» Колористика при окрашивании волос. Тест
Колористика при окрашивании волос. Тест Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна»)
Предложение по летнему корпоративному отдыху на стадионе «Труд» (пос. «Старая Купавна») Греческая вазопись
Греческая вазопись Холод в нефтянной промышленности
Холод в нефтянной промышленности Урок-путешествие по разделу «Были-небылицы». Оценка достижений
Урок-путешествие по разделу «Были-небылицы». Оценка достижений LobbyWorks
LobbyWorks Самоиндукция
Самоиндукция Correct сommunication. Правильное общение
Correct сommunication. Правильное общение Тема: «Положение человека в системе животного мира. Эволюция гоминид».
Тема: «Положение человека в системе животного мира. Эволюция гоминид». Презентация на тему Выживание в природных условиях после аварии
Презентация на тему Выживание в природных условиях после аварии  ангелы
ангелы Интеллектуально-познавательная игра
Интеллектуально-познавательная игра Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208-
Анализ применимости ПИК «СтОФ» для массовой оценки стоимости движимого имущества Тевелева Оксана Валерьевна тел: (499) 724-15-14, 8(903)208- Fruit and vegetables
Fruit and vegetables Ты подвиг совершил во имя жизни на земле
Ты подвиг совершил во имя жизни на земле Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите
Обязательства из односторонних сделок и из действий в чужом интересе. Обязательства из договоров, не подлежащие судебной защите ТВ - тюнеры
ТВ - тюнеры Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров
Применение программного комплекса CorPos (FORCE Technology Norway AS) для диагностики и прогнозирования коррозии на внутренних стенках газопров Евгений Замятин
Евгений Замятин Characteristic of grain mass
Characteristic of grain mass