Содержание
- 2. Периодический закон Д .И Менделеева и его высказанные на его основе гипотезы явились стимулом к выяснению
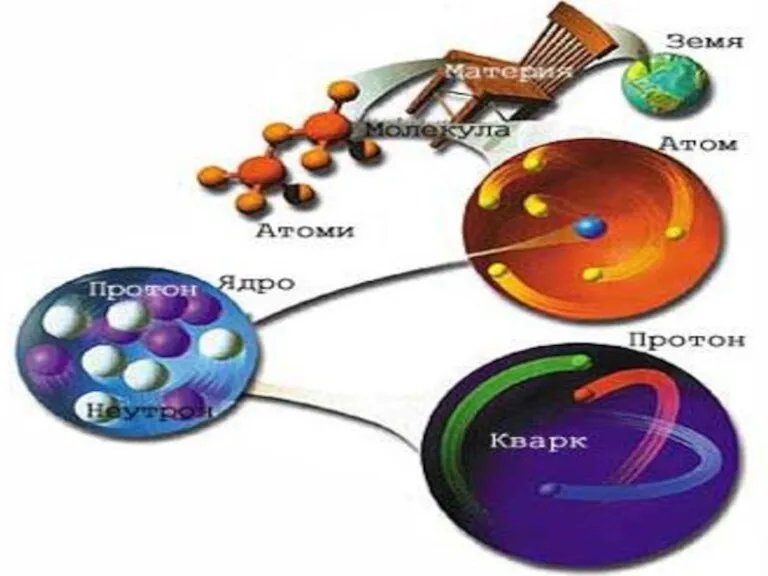
- 3. Атом (др.-греч. ἄτομος — неделимый) 1. Атом – микрочастица, имеющая форму шара. 2. Атом состоит из
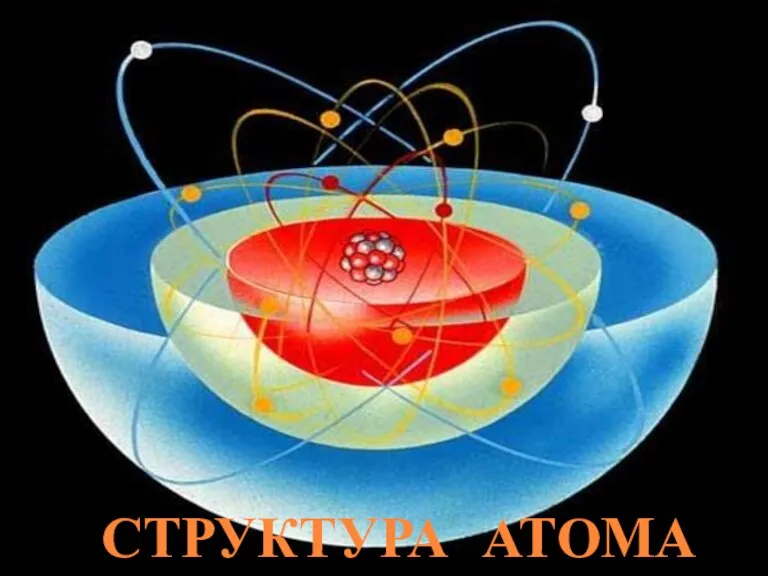
- 4. Структура атома
- 5. В 1911 г. английский ученый Э. Резерфорд доказал ,что в центре атома имеется положительно заряженное ядро.
- 6. Резерфорд предположил, что атом устроен подобно планетарной системе. Суть модели строения атома по Резерфорду заключается в
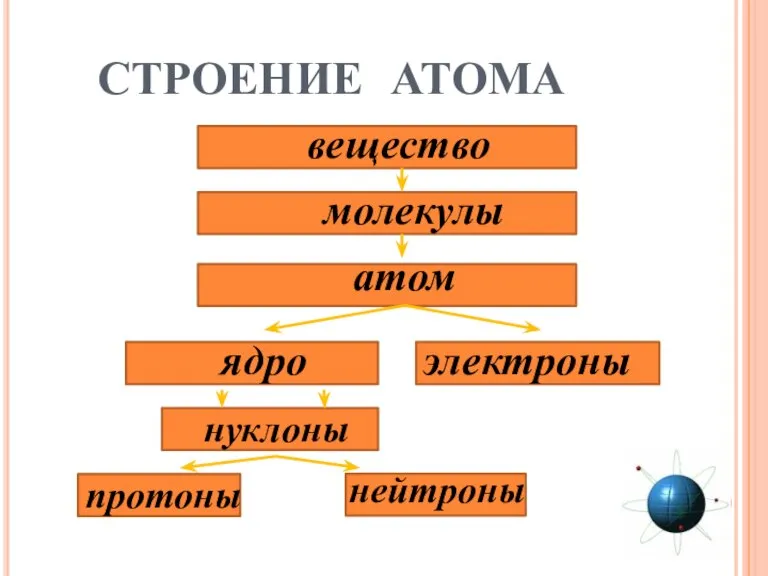
- 7. На основании опытов Резерфорда было установлено: Протон Нейтрон P+ n0 «Нуклеус» (латинское nucleus) – ядро. Масса
- 8. СТРОЕНИЕ АТОМА вещество молекулы атом нуклоны
- 10. Строение атома на примере О +8О ( 1)Число протонов и электронов равны порядковому номеру элемента 2)Что
- 11. У кислорода порядковый номер равен 8 ,поэтому число электронов и протонов равны 8,а молекулярная масса кислорода
- 12. 5 формул строения атома 1)Определение числа протонов, электронов и нейтронов у елемента 2)Распределение электронов по энергетическим
- 14. Скачать презентацию








 Станковая скульптура: бюст
Станковая скульптура: бюст Отчёт директората цифрового телевидения Alma tv за период с 13 по 19 Октября 2017г
Отчёт директората цифрового телевидения Alma tv за период с 13 по 19 Октября 2017г Системный подход на благо людей и природы
Системный подход на благо людей и природы Живете
Живете Этико-правовые проблемы конца жизни человека
Этико-правовые проблемы конца жизни человека ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ПОЖАРОВ В ЖИЛЫХ И ОБЩЕСТВЕННЫХ ЗДАНИЯХ.
ПРИЧИНЫ ВОЗНИКНОВЕНИЯ ПОЖАРОВ В ЖИЛЫХ И ОБЩЕСТВЕННЫХ ЗДАНИЯХ. УСПЕНСКИЙ СОБОР
УСПЕНСКИЙ СОБОР Опале листя: користь чи шкода
Опале листя: користь чи шкода Государственное управление в области природопользования и охраны окружающей среды
Государственное управление в области природопользования и охраны окружающей среды Магнитная гидродинамика солнечных явлений
Магнитная гидродинамика солнечных явлений Пишем проект!
Пишем проект! Этапы речевого развития
Этапы речевого развития Растения Чувашской республики
Растения Чувашской республики Эффективность стратегии диверсификации на российском рынке(эмпирическое исследование)
Эффективность стратегии диверсификации на российском рынке(эмпирическое исследование) Стресс и пути его преодоления
Стресс и пути его преодоления Интерактивные формы и методы в преподавании русского языка и литературы. Тема: Групповые формы работы на уроках русского языка и л
Интерактивные формы и методы в преподавании русского языка и литературы. Тема: Групповые формы работы на уроках русского языка и л Западный и Восточный типы культуры
Западный и Восточный типы культуры Упражнение Настроение
Упражнение Настроение Выполняй правила безопасности на дороге!
Выполняй правила безопасности на дороге! Тихонова Тамара Вячеславовна учитель истории и обществознания ГОУ лицей № 150
Тихонова Тамара Вячеславовна учитель истории и обществознания ГОУ лицей № 150 ОРКиСЭ
ОРКиСЭ Непревзойденные преимущества систем T2Red + T2Reflecta
Непревзойденные преимущества систем T2Red + T2Reflecta Модели данных
Модели данных  Модель организации внеурочной деятельности на основе краткосрочных курсов
Модель организации внеурочной деятельности на основе краткосрочных курсов История развития системы железнодорожной автоматики, применяемые на железнодорожном транспорте (АТМ) в России
История развития системы железнодорожной автоматики, применяемые на железнодорожном транспорте (АТМ) в России Высокоранговые и Низкопримативные правят миром
Высокоранговые и Низкопримативные правят миром Ртуть
Ртуть Презентация на тему: клавиатура.Авторы: Суханов Г.
Презентация на тему: клавиатура.Авторы: Суханов Г.