Содержание
- 2. Вспомните! Какие степени окисления проявляет азот в своих оксидах? Какие окислы азота вы знаете? Расскажите о
- 4. Изучение свойств азотной кислоты, Её значения в хозяйственной деятельности человека.
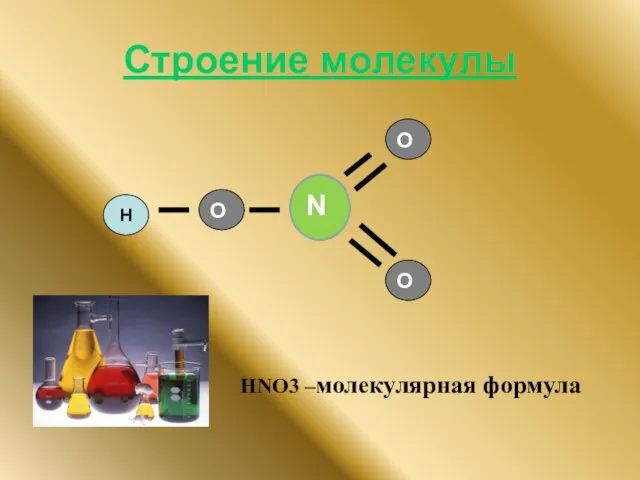
- 5. Строение молекулы Н O O O HNO3 –молекулярная формула N
- 6. Физические свойства азотной кислоты Рассмотрите выданные вам образцы азотной кислоты. Проверьте цвет, прозрачность, растворимость в воде.
- 7. Химические свойства азотной кислоты Очень сильная кислота В водном растворе диссоциирует: НNO3 ↔NO3 + H Взаимодействует:
- 8. Особые свойства Cu +4HNO3 = Cu(NO3)2 +2NO2↑ +2H2O При нагревании выделяется бурый газ, он ядовит для
- 9. Производство азотной кислоты Окисление азота воздуха. Доокисление оксида азота+2 в оксид азота +4 Получение азотной кислоты.
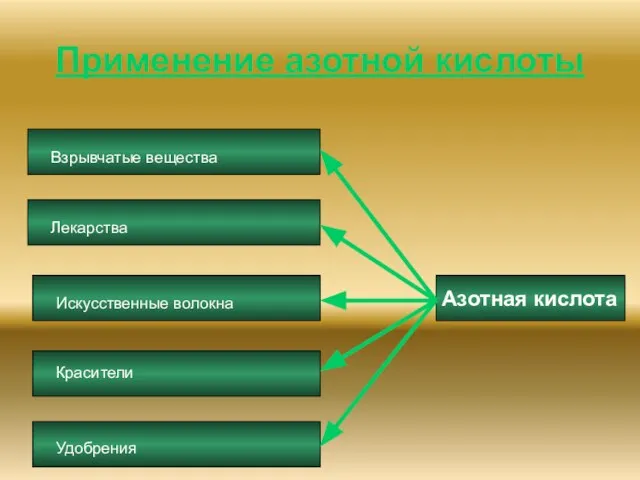
- 10. Применение азотной кислоты Азотная кислота Взрывчатые вещества Лекарства Искусственные волокна Красители Удобрения
- 11. Нитраты NaNO3 KNO3 NH4NO3 Ca(NO3)2 Соли азотной кислоты называются ещё селитрами. Они применяются при производстве спичек,
- 12. Закрепление 2KNO3→2KNO2 +O2 Качественная реакция на нитраты. Решите правильно или неправильно предложенное Вам выссказывание: 1. Азотная
- 13. Закрепление 3. Азотная кислота образует соли – нитриты. 4. Азотная кислота образует соли- нитраты. 5. В
- 14. Закрепление 8. Азотная кислота не реагирует с любыми металлами. 9. Азотная кислота реагирует с оксидами металлов.
- 15. Проверьте свои знания: Правильные ответы: 1,4,5, 9,10,11,12.
- 17. Скачать презентацию












 Установление империи в Риме
Установление империи в Риме Шаблон презентации
Шаблон презентации Моя родина - Россия 4 класс
Моя родина - Россия 4 класс Семинар 1. Знакомство с языками программирования
Семинар 1. Знакомство с языками программирования Оценка инвестиционных проектов
Оценка инвестиционных проектов Презентация на тему "Формы работы с активом детских организаций (Методические рекомендации организаторам детского движения )&quo
Презентация на тему "Формы работы с активом детских организаций (Методические рекомендации организаторам детского движения )&quo 2 сентября 2009 г.
2 сентября 2009 г. Презентация на тему Мой любимый Волгодонск
Презентация на тему Мой любимый Волгодонск Международная Инвестиционная Премия «Инвестиционный Ангел»
Международная Инвестиционная Премия «Инвестиционный Ангел» Импульс
Импульс Розробити технологічний процес складання та ремонту противопожежної системи двигунів АІ-450М вертольота МІ-2МСБ
Розробити технологічний процес складання та ремонту противопожежної системи двигунів АІ-450М вертольота МІ-2МСБ Противоэрозионные мероприятия
Противоэрозионные мероприятия Природа Европейского Севера
Природа Европейского Севера ИНДИКАТОРНЫЙ АНАЛИЗ
ИНДИКАТОРНЫЙ АНАЛИЗ  Дифференциация букв и звуков О-У
Дифференциация букв и звуков О-У Особенности развития современных дошкольников
Особенности развития современных дошкольников Рецепт успешного политического лидера
Рецепт успешного политического лидера Социально-психологическое сопровождение детей с ограничеными возможностями
Социально-психологическое сопровождение детей с ограничеными возможностями Допинг
Допинг тестирование обучающихся образовательных учреждений Санкт-Петербурга с использованием АИС «Знак» по общеобразовательным пред
тестирование обучающихся образовательных учреждений Санкт-Петербурга с использованием АИС «Знак» по общеобразовательным пред ПРИЗНАКИ ТЕКСТА
ПРИЗНАКИ ТЕКСТА 22 марта 2011 г. Процедура проведения закупок кафедрами и подразделениями в 2011 году
22 марта 2011 г. Процедура проведения закупок кафедрами и подразделениями в 2011 году Наши соседи - белки
Наши соседи - белки Седация в анестезиологии и интенсивной терапии
Седация в анестезиологии и интенсивной терапии но
но Предстартовый синдром. Психологическая подготовка спортсмена
Предстартовый синдром. Психологическая подготовка спортсмена The Political Consequences of Brexit
The Political Consequences of Brexit УРОК - презентация "Олимпийские чемпионы"
УРОК - презентация "Олимпийские чемпионы"